Лактат
Лактат – это продукт клеточного метаболизма, производная молочной кислоты. Может находиться в клетках в виде самой молочной кислоты либо в виде ее солей.
Синонимы русские
Молочная кислота, соли молочной кислоты.
Синонимы английские
Lactate, lactic acid.
Метод исследования
Кинетический колориметрический метод.
Единицы измерения
Ммоль/л (миллимоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
В ходе анализа измеряется количество лактатов в крови.
В норме концентрация лактатов в крови очень низкая. В мышцах, эритроцитах, клетках мозга и в других тканях она повышается при недостатке кислорода в клетке либо если первичный путь производства энергии в клетках нарушен.
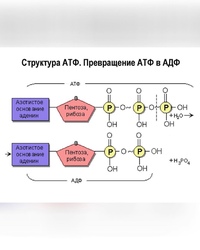
Основные запасы клеточной энергии производятся в митохондриях, крошечных «энергетических станциях» внутри клеток организма. Митохондрии используют глюкозу и кислород для производства АТФ (аденозинтрифосфата), главного энергетического источника в организме. Это называется аэробным образованием энергии.
При падении уровня кислорода в клетке либо при нарушении нормального функционирования митохондрий организм переключается на менее эффективное производство энергии (анаэробное) путем расщепления глюкозы с образованием АТФ. Лактат является основным побочным продуктом этого анаэробного процесса.
Причины повышения уровня лактатов подразделяются на две группы в соответствии с механизмом, который вызывает лактацидоз.
Лактацидоз А-типа наиболее распространен и ассоциирован с факторами, вызывающими недостаточный захват кислорода легкими либо замедленное кровообращение, что приводит к уменьшению снабжения тканей кислородом. Примеры лактацидоза А-типа:
- шок в результате полученной травмы или сильной кровопотери,
- сепсис,
- инфаркт,
- застойная сердечная недостаточность,
- тяжелые легочные либо респираторные заболевания,
- отек легких,
- тяжелые формы анемии.

Лактацидоз Б-типа не связан с поступлением кислорода к тканям, он является причиной повышенной потребности в кислороде из-за проблем обмена веществ. Примеры лактацидоза Б-типа:
- болезни печени,
- почечные заболевания,
- сахарный диабет,
- лейкемия,
- СПИД,
- болезни, связанные с сохранением гликогена (например, глюкозо-6-фосфатазная недостаточность),
- лекарства и токсины, такие как салицилаты, цианиды, метанол, метформин,
- различные наследственные митохондриальные и метаболические заболевания, являющиеся формами мышечной дистрофии и затрагивающие синтез АТФ,
- состояние при интенсивных физических нагрузках.
Для чего используется исследование?
- Для выявления лактацидоза, то есть высокого содержания лактатов.
- Чтобы определить гипоксию и лактацидоз и оценить их тяжесть, если есть факторы, понижающие снабжение кислородом клеток и тканей (лактацидоз чаще всего возникает именно из-за этого), например шок или застойная сердечная недостаточность.

- Для оценки кислотно-щелочного баланса и оксигенации (вместе с анализом на газы в крови).
- При диагностике болезней, которые способны привести к повышенному содержанию лактатов, а также при симптомах ацидоза, поскольку лактацидоз может вызываться факторами, не связанными с уровнем кислорода в тканях.
- Чтобы выяснить, не являются ли сопутствующие заболевания, например болезни печени или почек, причиной лактацидоза (вместе с другими исследованиями, такими как клинический анализ крови или мочи, некоторые биохимические тесты).
- Для обследования больных с подозрением на сепсис. Если уровень лактатов у них падает ниже нормы, лечение им назначается незамедлительно. При своевременной диагностике и безотлагательном лечении сепсиса шансы на успешное выздоровление увеличиваются во много раз.
- Для наблюдения за течением гипоксии и контроля за эффективностью ее лечения в случае обострения таких болезней, как сепсис, инфаркт и застойная сердечная недостаточность.

Когда назначается исследование?
- При симптомах недостатка кислорода (одышка, учащенное дыхание, бледность, потливость, тошнота, слабость в мышцах).
- При подозрении на сепсис, шок, инфаркт, сердечную недостаточность, почечную недостаточность или сахарный диабет.
- При острых головных болях, лихорадке, расстройстве и потере сознания, а также признаках менингита.
Что означают результаты?
Референсные значения: 0,5 – 2,2 ммоль/л.
Клиническое значение имеет лишь повышение концентрации лактата в крови.
- Высокая концентрация лактата указывает на болезнь (либо иные факторы), которая является причиной накопления лактатов в тканях. В целом чем выше уровень лактатов, тем острее протекает заболевание. Если накопление лактатов связано с гипоксией, то их повышение означает, что организм не способен ее компенсировать. В то же время сама по себе избыточная концентрация лактатов не является прямым указанием на диагноз, она лишь помогает подтвердить либо исключить возможные причины наблюдаемых симптомов.
- Если есть подозрение на состояние, ведущее к кислородной недостаточности, например на шок, полученный в результате травмы или сильной кровопотери, сепсис, инфаркт, застойную сердечную недостаточность, острые респираторные или легочные заболевания, отек легких, острую анемию, то повышенный уровень лактатов может быть признаком гипоксии и/или дисфункции органов.
- Иногда лактацидоз является осложнением болезней печени, почек, диабета, лейкемии, СПИДа, болезней, связанных с сохранением гликогена (например, глюкозо-6-фосфатазной недостаточностью), различных наследственных митохондриальных и метаболических заболеваний (форм мышечной дистрофии и тех, которые затрагивают синтез АТФ).
- Увеличивать концентрацию лактатов способны лекарства и токсины (салицилаты, цианиды, метанол, метформин) и интенсивные физические нагрузки.
- При симптомах менингита значительно повышенный уровень лактатов в цереброспинальной жидкости указывает на вероятность бактериального менингита, в то время как слегка повышенный – на его вирусную разновидность.

- Нормальный уровень лактатов свидетельствует о том, что у пациента нет лактацидоза, а также о достаточном снабжении кислородом на клеточном уровне.
- При лечении лактацидоза или гипоксии уменьшение концентрации лактатов со временем отражает реакцию организма на процесс лечения.
ГЛИКОЛИЗ • Большая российская энциклопедия
Авторы: А. Е. Медведев
ГЛИКО́ЛИЗ (от греч. γλυϰύς – сладкий и …лиз), ферментативный процесс анаэробного (протекающего без участия кислорода) расщепления глюкозы, сопровождающийся накоплением энергии, запасаемой в виде аденозинтрифосфата (АТФ). Широко распространён в природе, играет важную роль в метаболизме живых организмов. Г. лежит в основе разл. видов брожения. У облигатных анаэробных микроорганизмов, а также в некоторых клетках животных и человека (напр., зрелые эритроциты млекопитающих) Г. – единственный процесс, поставляющий энергию. В аэробных условиях у большинства организмов Г. предшествует окислительному распаду органич. соединений до СО2 и Н2О. У высших животных Г. интенсивно протекает в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, быстро делящихся (в т. ч. опухолевых) клетках. Ферменты Г. локализованы в растворимой части цитоплазмы клеток.
В аэробных условиях у большинства организмов Г. предшествует окислительному распаду органич. соединений до СО2 и Н2О. У высших животных Г. интенсивно протекает в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, быстро делящихся (в т. ч. опухолевых) клетках. Ферменты Г. локализованы в растворимой части цитоплазмы клеток.
Полная детальная расшифровка отд. реакций Г. была осуществлена гл. обр. благодаря работам немецких биохимиков Г. Эмбдена, О. Мейергофа, О. Варбурга, К. Нойберга, а также Я. О. Парнаса и К. Кори (1930–37). Иногда Г. называют «путём Эмбдена – Мейергофа – Парнаса».
Условно в процессе Г. выделяют две стадии. На первой (подготовительной) сначала происходит фосфорилирование глюкозы (реакция 1), катализируемое ферментом гексокиназой (иногда глюкокиназой) и требующее затраты энергии молекулы АТФ (см. схему). Образовавшийся глюкозо-6-фосфат при участии фермента фосфоглюкоизомеразы превращается (2) во фруктозо-6-фосфат, который в свою очередь фосфорилируется (для этого требуется ещё одна молекула АТФ) с помощью фосфофруктокиназы-1 (3) с образованием фруктозо-1,6-дифосфата. Последний с помощью фруктозо-1,6-дифосфатальдолазы (4) расщепляется до двух фосфотриоз: глицеральдегид-3-фосфата и дигидроксиацетонфосфата. Последний легко изомеризуется под действием триозофосфатизомеразы в глицеральдегид-3-фосфат (5). В дальнейшем используется только первое соединение. Т. о., из одной молекулы глюкозы на первой стадии Г. образуются две молекулы глицеральдегид-3-фосфата и при этом используется энергия двух молекул АТФ. На второй – осн. стадии Г. – глицеральдегид-3-фосфат претерпевает серию последовательных превращений, приводящих к образованию пировиноградной кислоты (ионизированная формула – пируват) и выделению энергии, аккумулируемой в виде АТФ.
схему). Образовавшийся глюкозо-6-фосфат при участии фермента фосфоглюкоизомеразы превращается (2) во фруктозо-6-фосфат, который в свою очередь фосфорилируется (для этого требуется ещё одна молекула АТФ) с помощью фосфофруктокиназы-1 (3) с образованием фруктозо-1,6-дифосфата. Последний с помощью фруктозо-1,6-дифосфатальдолазы (4) расщепляется до двух фосфотриоз: глицеральдегид-3-фосфата и дигидроксиацетонфосфата. Последний легко изомеризуется под действием триозофосфатизомеразы в глицеральдегид-3-фосфат (5). В дальнейшем используется только первое соединение. Т. о., из одной молекулы глюкозы на первой стадии Г. образуются две молекулы глицеральдегид-3-фосфата и при этом используется энергия двух молекул АТФ. На второй – осн. стадии Г. – глицеральдегид-3-фосфат претерпевает серию последовательных превращений, приводящих к образованию пировиноградной кислоты (ионизированная формула – пируват) и выделению энергии, аккумулируемой в виде АТФ. Сначала при участии фермента глицеральдегид-3-фосфатдегидрогеназы (6), в присутствии кофермента никотинамидадениндинуклеотида (НАД), который участвует в окислении альдегидной группы, переходя при этом в восстановленную форму (НАДН), и неорганического фосфата (Фн) происходит превращение глицеральдегид-3-фосфата в высокоэнергетическое соединение – 1,3-ди-фосфоглицерат. Затем в реакции т. н. субстратного фосфорилирования, которую осуществляет фермент фосфоглицераткиназа (7), происходит перенос фосфорильной группы с 1,3-дифосфоглицерата на аденозиндифосфат (АДФ) с образованием АТФ. Другой продукт этой реакции – 3-фосфоглицерат при участии фермента фосфоглицератмутазы (8) подвергается изомеризации в 2-фосфоглицерат. После этого в результате реакции отщепления молекулы воды, которую осуществляет фермент енолаза (9), происходит образование фосфоенолпирувата и в процессе ещё одной реакции субстратного фосфорилирования, которую катализирует фермент пируваткиназа (10), фосфорильная группа фосфоенолпирувата переносится на АДФ с образованием очередной молекулы АТФ.
Сначала при участии фермента глицеральдегид-3-фосфатдегидрогеназы (6), в присутствии кофермента никотинамидадениндинуклеотида (НАД), который участвует в окислении альдегидной группы, переходя при этом в восстановленную форму (НАДН), и неорганического фосфата (Фн) происходит превращение глицеральдегид-3-фосфата в высокоэнергетическое соединение – 1,3-ди-фосфоглицерат. Затем в реакции т. н. субстратного фосфорилирования, которую осуществляет фермент фосфоглицераткиназа (7), происходит перенос фосфорильной группы с 1,3-дифосфоглицерата на аденозиндифосфат (АДФ) с образованием АТФ. Другой продукт этой реакции – 3-фосфоглицерат при участии фермента фосфоглицератмутазы (8) подвергается изомеризации в 2-фосфоглицерат. После этого в результате реакции отщепления молекулы воды, которую осуществляет фермент енолаза (9), происходит образование фосфоенолпирувата и в процессе ещё одной реакции субстратного фосфорилирования, которую катализирует фермент пируваткиназа (10), фосфорильная группа фосфоенолпирувата переносится на АДФ с образованием очередной молекулы АТФ.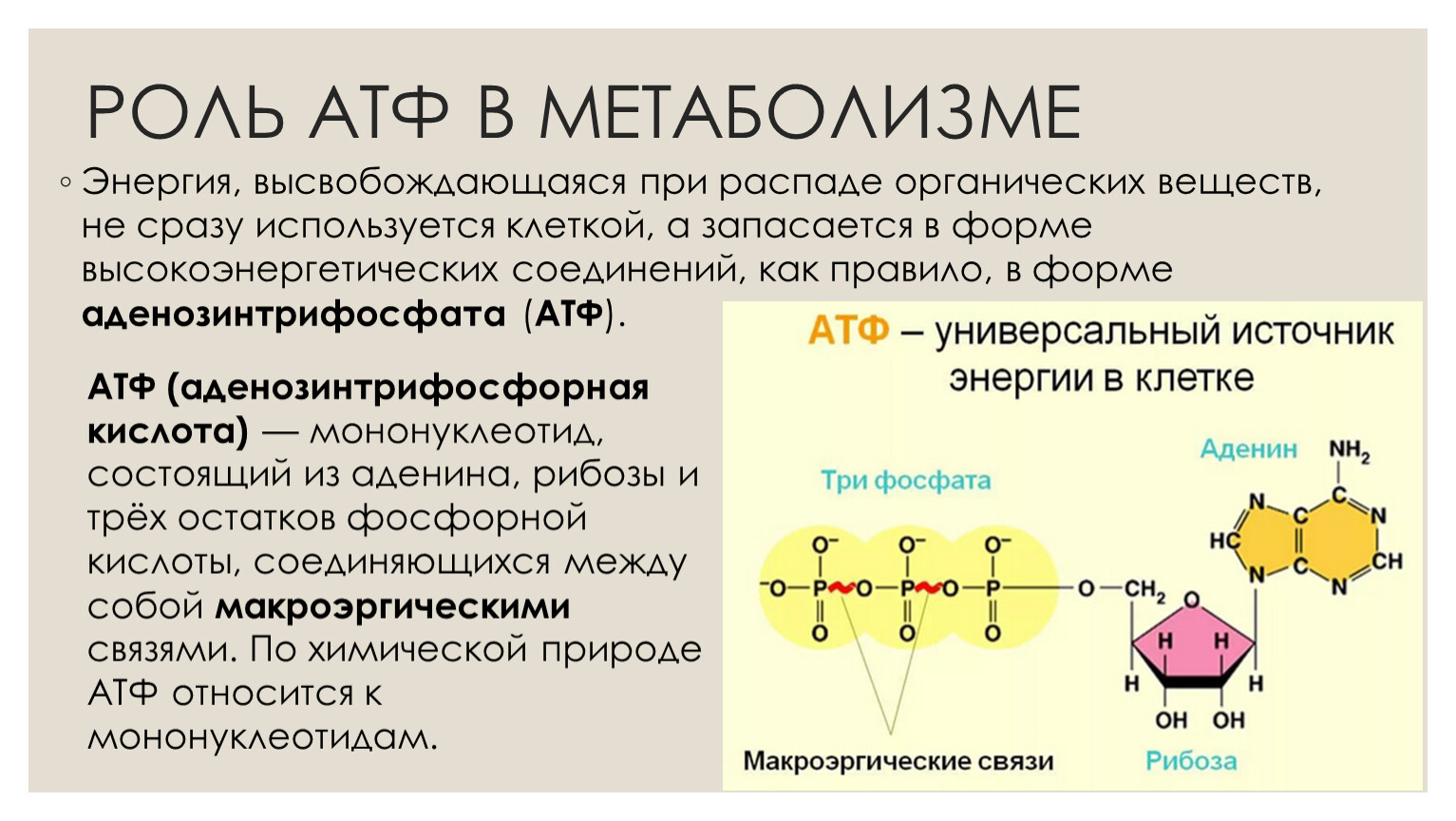 Следовательно, за вычетом затраченных на подготовительной стадии двух молекул АТФ в конечном итоге при распаде глюкозы образуются две молекулы АТФ.
Следовательно, за вычетом затраченных на подготовительной стадии двух молекул АТФ в конечном итоге при распаде глюкозы образуются две молекулы АТФ.
Схема гликолиза.
Дальнейшая судьба образовавшегося пирувата и НАДН определяется особенностями метаболизма конкретных типов клеток и их обеспеченностью кислородом. В аэробных условиях пируват и восстановленные эквиваленты от НАДН (гидрид-ион) поступают в митохондрии, где происходит превращение пирувата в ацетил-КоА (см. Кофермент А), который поступает в трикарбоновых кислот цикл. В отсутствии кислорода НАДН используется на восстановление пирувата в лактат (ионизированная форма молочной кислоты). Это необходимо для получения НАД, без которого невозможно протекание глицеральдегид-3-фосфатдегидрогеназной реакции, а значит и всего Г. В молочнокислых бактериях, а также в белых мышцах (обеднённых митохондриями по сравнению с красными мышцами) лактат является конечным продуктом Г. У дрожжей пируват превращается в этанол (спиртовое брожение). Др. гексозы (галактоза, манноза, фруктоза), пентозы и глицерин могут включаться в Г. на разных его стадиях (напр., стадии 2, 3, 5). Поставщиком остатков глюкозы для нужд Г. у животных может также служить гликоген (в этом случае процесс называют гликогенолизом, он наиболее интенсивно протекает в мышцах), а у растений – крахмал, остатки глюкозы которых вовлекаются в Г. благодаря действию ферментов, приводящих к образованию сначала глюкозо-1-фосфата, а затем глюкозо-6-фосфата. В присутствии кислорода скорость Г. снижается в связи с началом процесса дыхания (эффект Пастера), которое обеспечивает более эффективный механизм образования богатых энергией связей. В опухолевых клетках, безъядерных эритроцитах, эмбриональных и некоторых других тканях эффект Пастера ослаблен или отсутствует вовсе (т.
У дрожжей пируват превращается в этанол (спиртовое брожение). Др. гексозы (галактоза, манноза, фруктоза), пентозы и глицерин могут включаться в Г. на разных его стадиях (напр., стадии 2, 3, 5). Поставщиком остатков глюкозы для нужд Г. у животных может также служить гликоген (в этом случае процесс называют гликогенолизом, он наиболее интенсивно протекает в мышцах), а у растений – крахмал, остатки глюкозы которых вовлекаются в Г. благодаря действию ферментов, приводящих к образованию сначала глюкозо-1-фосфата, а затем глюкозо-6-фосфата. В присутствии кислорода скорость Г. снижается в связи с началом процесса дыхания (эффект Пастера), которое обеспечивает более эффективный механизм образования богатых энергией связей. В опухолевых клетках, безъядерных эритроцитах, эмбриональных и некоторых других тканях эффект Пастера ослаблен или отсутствует вовсе (т. н. аэробный Г.).
н. аэробный Г.).
Все реакции Г., за исключением 1, 3 и 10-й, обратимы. Ферменты, катализирующие эти три реакции, являются объектами сложной регуляции. Скорость Г. лимитирует фосфофруктокиназа-1. Этот фермент активируют фруктозо-2,6-дифосфат, АДФ и аденозинмонофосфат (АМФ), а ингибируют АТФ и цитрат (ионизированная форма лимонной кислоты). АТФ подавляет также активность гексокиназы и пируваткиназы. Образование мощного активатора Г. – фруктозо-2,6-дифосфата – из фруктозо-6-фосфата осуществляет особый фермент фосфофруктокиназа-2. Гормоны адреналин и глюкагон через систему внутриклеточной сигнализации, включающую образование циклического 3’,5’-аденозинмонофосфата (цАМФ) и активацию фермента протеинкиназы, вызывают фосфорилирование и инактивацию пируваткиназы в печени, но не в мышцах. Такая тканеспецифичная регуляция необходима для эффективного протекания глюконеогенеза в печени.
Установлено, что некоторым ферментам Г. свойствен ряд функций, не связанных с этим процессом. Напр., глицеральдегид-3-фосфатдегидрогеназа может переноситься в ядро и участвовать в индукции апоптоза, активируя процессы транскрипции.
обширное семейство белков лейциновой молнии, способных избирательно образовывать гетеродимеры, связывающиеся с ДНК.
- Т. В. Хай,
- Ф Лю,
- В. Дж. Кукос и
- МР Зеленый
- Кафедра биохимии и молекулярной биологии, Гарвардский университет, Кембридж, Массачусетс 02138.
Abstract
Сайт связывания активирующего фактора транскрипции (ATF) (консенсусная последовательность 5′-GTGACGTACAG-3′) представляет собой присутствующий элемент промотора
в широком спектре вирусных и клеточных генов. Два наиболее хорошо охарактеризованных класса генов, которые содержат сайты ATF, являются E1A-индуцируемыми.
аденовирусные гены и цАМФ-индуцируемые клеточные гены. Здесь мы сообщаем о выделении восьми клонов кДНК ATF, каждый из которых
происходит от отдельного гена. Все исследованные клоны кДНК ATF содержат мотив лейциновой молнии и в значительной степени сходны.
между собой только в пределах этого региона. Область лейциновой молнии белков ATF также похожа на область AP-1/c-jun.
семейство факторов транскрипции, сайт связывания ДНК которых отличается от сайта связывания ATF в одном положении. Связывание ДНК
исследования выявили два механизма создания дальнейшего разнообразия из белков ATF. Во-первых, некоторые, но не все комбинации
Белки ATF образуют гетеродимеры, которые эффективно связываются с ДНК. Во-вторых, хотя все белки ATF связываются с сайтом ATF, их
точные взаимодействия с ДНК отличаются друг от друга, о чем свидетельствует анализ интерференции метилирования.
Два наиболее хорошо охарактеризованных класса генов, которые содержат сайты ATF, являются E1A-индуцируемыми.
аденовирусные гены и цАМФ-индуцируемые клеточные гены. Здесь мы сообщаем о выделении восьми клонов кДНК ATF, каждый из которых
происходит от отдельного гена. Все исследованные клоны кДНК ATF содержат мотив лейциновой молнии и в значительной степени сходны.
между собой только в пределах этого региона. Область лейциновой молнии белков ATF также похожа на область AP-1/c-jun.
семейство факторов транскрипции, сайт связывания ДНК которых отличается от сайта связывания ATF в одном положении. Связывание ДНК
исследования выявили два механизма создания дальнейшего разнообразия из белков ATF. Во-первых, некоторые, но не все комбинации
Белки ATF образуют гетеродимеры, которые эффективно связываются с ДНК. Во-вторых, хотя все белки ATF связываются с сайтом ATF, их
точные взаимодействия с ДНК отличаются друг от друга, о чем свидетельствует анализ интерференции метилирования.
Сноски
- Copyright © Cold Spring Harbour Laboratory Press
« Предыдущая | Следующая статья » Содержание
Эта статья
дои: 10.1101/гад.3.12б.2083 Гены и Дев. 1989. 3: 2083-2090 Авторские права © Лаборатория Колд Спринг Харбор Пресс
- ИССЛЕДОВАТЕЛЬСКАЯ СТАТЬЯ
- Ссылка на PubMed
- Статьи Hai, T.
 W.
W. - Статьи Грина, М. Р.
Просмотреть все …
Твиты от @genesdevТекущий выпуск
- 1 мая 2023 г., 37 (9-10)
Элементы ATF/CREB в промоутерах латентно-ассоциированного транскрипта вируса простого герпеса типа 1 взаимодействуют с членами семейств транскрипционных факторов ATF/CREB и AP-1
- DOI:10.
 1159/000025361 9 0004
1159/000025361 9 0004 - Идентификатор корпуса: 1279623
@article{Millhouse1998ATFCREBEI,
title={Элементы ATF/CREB в промоутерах латентно-ассоциированного транскрипта вируса простого герпеса типа 1 взаимодействуют с членами семейств факторов транскрипции ATF/CREB и AP-1},
автор = {Скотт Миллхаус, Дж. Дж. Кенни, Патрик Дж. Куинн, Вивьен Ли и Брайан Вигдал},
journal={Журнал биомедицинских наук},
год = {1998},
громкость = {5},
страницы = {451 - 464}
} - S. Millhouse, J. J. Kenny, B. Wigdahl
- Опубликовано 1 ноября 1998 г.
- Biology
- Journal of Biomedical Science
V-1) латентно-ассоциированный транскрипт (LAT) промотор 1 (LP1) представляет собой индуцируемый и специфичный для типа клеток промотор, участвующий в регуляции продукции первичного транскрипта LAT размером 8,3 т.п.н. во время острой и латентной инфекции периферических сенсорных нейронов и во время последующей реактивации вируса. Ряд цис-действующих регуляторных элементов был идентифицирован в LP1, включая две последовательности, подобные циклическому AMP (cAMP) элементу ответа (CRE), обозначенные CRE-1 и CRE-2. КРЭ-1…
Ряд цис-действующих регуляторных элементов был идентифицирован в LP1, включая две последовательности, подобные циклическому AMP (cAMP) элементу ответа (CRE), обозначенные CRE-1 и CRE-2. КРЭ-1…
Посмотреть в PubMed
doi.org
Ответный элемент цАМФ в ассоциированном с латентностью транскрипт-промоторе HSV-1 способствует индуцированной реактивации глаза в модели гипертермии у мышей.
- M. Marquart, X. Zheng, R. Tran, H. Thompson, D. Bloom, J. Hill
- 2001
Biology
Вирусология
Перекрестные помехи CREB и Fos/Jun на одном цис-элементе: репрессия транскрипции гена стероидогенного острого регуляторного белка.
- P. Manna, D. Stocco
- 2007
Biology
Journal of молекулярной эндокринологии

Ранний репрессор индуцируемого циклического АМФ вызывает реактивацию латентного вируса простого герпеса типа 1 в нейронах In Vitro
- M. Colgin, Roderic L. Smith, C. Wilcox
- 2001
Biology
Journal of Virology
Роль активирующего фактора транскрипции 3 в синтезе латентно-ассоциированного транскрипта и поддержании вируса простого герпеса 1 в латентном состоянии в ганглиях
- M. Shu, Te Du, G. Zhou, B. Roizman
- 2015
Биология
Национальная академия наук
Молекулярная схема, регулирующая латентность вируса простого герпеса типа 1 в нейронах.
- S.
- 2000
 Millhouse, B. Wigdahl
Millhouse, B. WigdahlBiology
Journal of neurovirology
Транскрипционная регуляция латентно-ассоциированных транскриптов (LAT) вирусов простого герпеса
- Ying Zhang, Qiang Xin, H. Xin
- 2020
Biology
Journal of Cancer
Противовирусная активность ингибиторов протеасом при инфекции вирусом простого герпеса-1: роль ядерного фактора-κB
- S.
- 2006
 L. Frazia, C. Amici, M. Santoro
L. Frazia, C. Amici, M. SantoroБиология, химия
Противовирусная терапия
Ингибирование стресс-активируемой киназы p38 не влияет на программу транскрипции вируса простого герпеса типа 1.
- G. Karaca, D. Hargett, S. Bachenheimer
- 2004
Биология
Вирусология
Молекулярная характеристика энхансерной области LATP2 вируса простого герпеса-1.
- C. English
- 2006
Biology
Роль основных белков лейциновой молнии в регуляции транскрипции гена стероидогенного острого регуляторного белка
Идентификация второй ATF /CREB-подобный элемент в промоторе латентно-ассоциированного транскрипта (LAT) вируса простого герпеса типа 1 (HSV-1).
- Дж. Дж. Кенни, Ф. Кребс, Б. Вигдал
- 1994
Биология
Вирусология
Семейство восходящих стимулирующих факторов связывается с промотором транскрипта вируса простого герпеса типа 1, ассоциированным с латентностью.
- Дж. Дж. Кенни, С. Миллхаус, М. Вотринг, Б. Вигдал
- 1997
Биология
Virology

Промотор транскрипта, связанный с вирусом простого герпеса типа 1, активируется через Ras и Raf фактором роста нервов и бутиратом натрия в клетках PC12
- D. P. Frazier, D. Cox, E. Godshalk, P. Schaffer
- 1996
Biology
Journal of virology
Два латентно-активных промотора вируса простого герпеса типа 1 различаются по своему вкладу в связанную с латентностью экспрессию транскриптов во время литических и латентных инфекций
- X. Chen, M. Schmidt, W. Goins, J. Glorioso
- 1995
Biology
Journal of virology
 1 инфекции.
1 инфекции.Ассоциированный с латентностью промотор вируса простого герпеса типа 1 требует области ниже места начала транскрипции для долгосрочной экспрессии в течение латентности
Промотор ассоциированных с латентностью транскриптов вируса простого герпеса типа 1 содержит функциональный элемент ответа на цАМФ: роль транскриптов, ассоциированных с латентностью, и цАМФ в реактивации латентности вируса.
- D. Leib, K. Nadeau, S.A. Rundle, P. Schaffer
- 1991
Biology
Proceedings of the National Academy of Sciences of the United States of America

Регуляция и специфичная для типа клеток активность промотора, расположенного выше латентно-ассоциированного транскрипта вируса простого герпеса типа 1 7 Произошло резкое изменение относительной активности в пользу промотора LAT, так что он был в 45 и 200 раз сильнее, чем конструкции IE110K и SV40, соответственно, а для оптимальной активности в клетках нейробластомы требовались последовательности в области -1267 для -797, что мало влияло на активность клеток HeLa.
Роли цАМФ-ответного элемента и блока ТАТА в экспрессии транскриптов вируса простого герпеса типа 1, ассоциированных с латентностью.
- C. Ackland-Berglund, D. Davido, D. Leib
- 1995
Биология
Вирусология


