β-аланин, химические свойства, биологическая роль
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Уравнение реакций с 2-аминопропионовой кислотой. Химия 10 класс вопрос 12 параграф 37 Рудзитис – Рамблер/класс
Уравнение реакций с 2-аминопропионовой кислотой. Химия 10 класс вопрос 12 параграф 37 Рудзитис – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
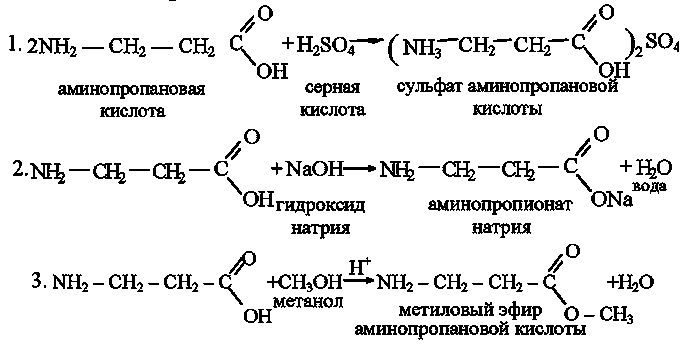
Добрый вечер! Помогите с домашним заданием! Сидим с сыном битый час( Составьте уравнения реакций
2- аминопропионовой кислоты: а) с гидроксидом калия; б) с серной кислотой; в) с этанолом.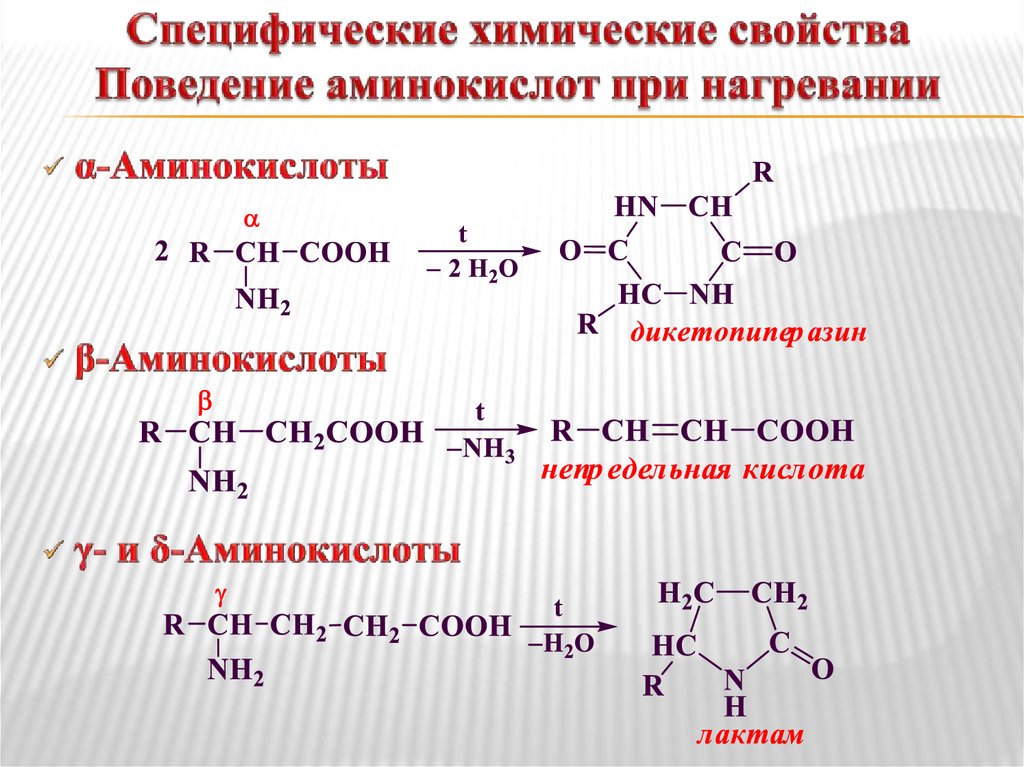
ответы
Я вас так понимаю! тоже мучаемся, им так много задают( Ловите ответ, мы прорешивали:
а) При реакции с гидроксидом калия 2-аминопропионовая кислота проявляет кислотные свойства:
б) При реакции с серной кислотой 2-аминопропионовая кислота проявляет основные свойства:
в) При реакции с этиловым спиртом образуется сложный эфир:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
9 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г. Е.
Е.
Почему сейчас школьники такие агрессивные ?
Читали новость про 10 классника который растрелял ? как вы к этому относитесь
Новости10 классБезопасность
Здравствуйте.
(Подробнее…)
Химия
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И. П.
П.
ВВОДЯЩИЕ АМИНОКИСЛОТЫ На этой странице объясняется, что такое аминокислоты, с упором на 2 аминокислоты, которые являются биологически важными. В нем подробно рассматриваются их простые физические свойства, такие как растворимость и температура плавления. Что такое аминокислоты? Структуры и названия Аминокислоты — это именно то, что они говорят! Это соединения, содержащие аминогруппу -NH 2 и группу карбоновой кислоты -COOH. В биологически важных аминокислотах аминогруппа присоединена к атому углерода рядом с группой -COOH. Они известны как 2-аминокислоты . Они также известны (что немного сбивает с толку) как альфа-аминокислоты . Именно на них мы сконцентрируемся. Двумя простейшими из этих аминокислот являются 2-аминоэтановая кислота и 2-аминопропановая кислота. Из-за биологической важности подобных молекул они обычно известны под своими традиционными биохимическими названиями. 2-аминоэтановая кислота, например, обычно называется глицин , а 2-аминопропановая кислота обычно известна как аланин . Общая формула 2-аминокислоты: . . . где «R» может быть довольно сложной группой, содержащей другие активные группы, такие как -OH, -SH, другие группы амина или карбоновой кислоты и так далее. Это определенно НЕ обязательно простая углеводородная группа! | ||
Примечание: Для полной точности одна из 20 биологически важных аминокислот (пролин) имеет немного другую структуру. Группа «R» загибается в кольцо, которое снова присоединяется к азоту вместо одного из атомов водорода. Это усложнение на самом деле не имеет большого значения для химического состава соединения — азот по-прежнему ведет себя так же, как и в других аминокислотах.  Это не то, о чем вам нужно беспокоиться в целях химии на этом вводном уровне. Это не то, о чем вам нужно беспокоиться в целях химии на этом вводном уровне. | ||
Физические свойства Точки плавления Аминокислоты представляют собой твердые кристаллические вещества с удивительно высокими температурами плавления. Трудно точно определить точки плавления, потому что аминокислоты имеют тенденцию разлагаться до того, как они расплавятся. Разложение и плавление, как правило, происходят в диапазоне 200-300°C. Для размера молекул это очень много. Должно произойти что-то необычное. Если вы еще раз посмотрите на общую структуру аминокислоты, то увидите, что она имеет как основную аминогруппу, так и кислую карбоксильную группу. Происходит внутренний перенос иона водорода из группы -COOH в группу -NH 2 , в результате чего остается ион как с отрицательным, так и с положительным зарядом. Это называется цвиттерион . Цвиттер-ион представляет собой соединение, не имеющее общего электрического заряда, но состоящее из отдельных частей, заряженных положительно и отрицательно. Это форма, в которой аминокислоты существуют даже в твердом состоянии. Вместо более слабых водородных связей и других межмолекулярных сил, которых вы могли бы ожидать, у вас на самом деле гораздо более сильное ионное притяжение между одним ионом и его соседями. Для разрыва этих ионных притяжений требуется больше энергии, поэтому аминокислоты имеют высокие точки плавления для размера молекул. Растворимость Аминокислоты обычно растворимы в воде и нерастворимы в неполярных органических растворителях, таких как углеводороды. Это снова отражает присутствие цвиттер-ионов. В воде ионное притяжение между ионами твердой аминокислоты заменяется сильным притяжением между полярными молекулами воды и цвиттер-ионами. Это почти то же самое, что и любое другое ионное вещество, растворяющееся в воде. Степень растворимости в воде зависит от размера и природы группы «R». | ||
Примечание: На этом этапе я обычно пытаюсь связать фактические значения растворимости различных аминокислот с их структурой. К сожалению, по имеющимся у меня значениям растворимости (и я не уверен, что они обязательно верны) я не могу найти никаких очевидных закономерностей — на самом деле, действительно бывают очень странные случаи. | ||
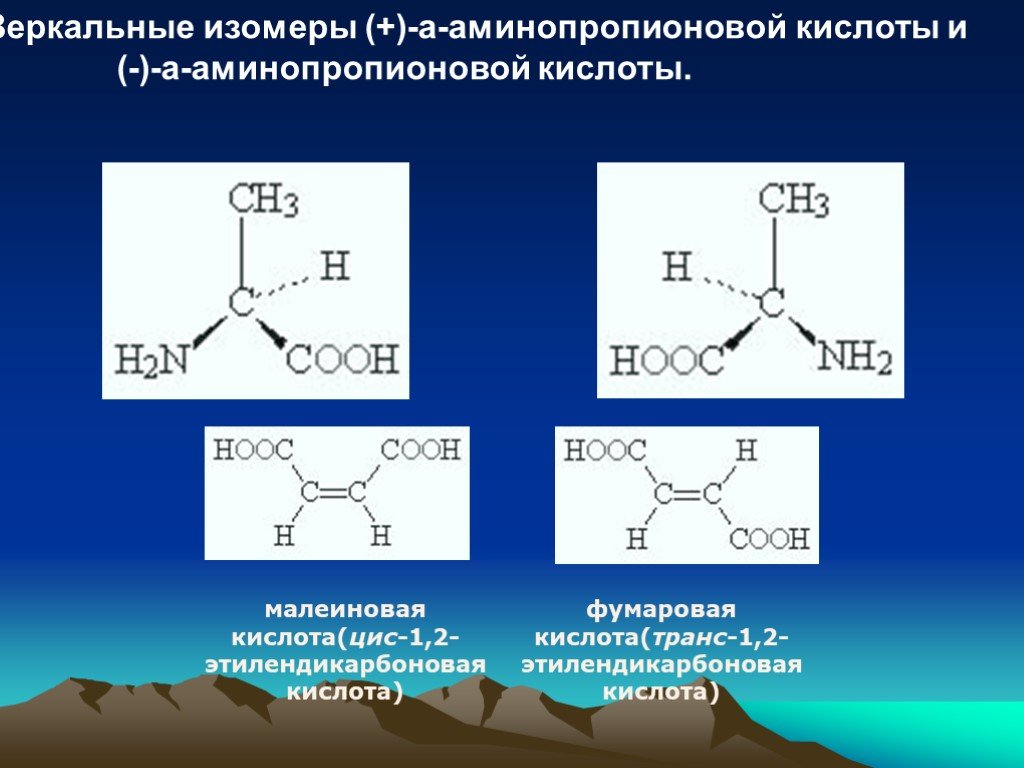
Отсутствие растворимости в неполярных органических растворителях, таких как углеводороды, связано с отсутствием притяжения между молекулами растворителя и цвиттер-ионами. Без сильного притяжения между растворителем и аминокислотой не будет выделяться достаточно энергии, чтобы разорвать ионную решетку. Оптическая активность Если вы еще раз взглянете на общую формулу аминокислоты, то увидите, что (кроме глицина, 2-аминоэтановой кислоты) углерод в центре структуры имеет четыре разные присоединенные группы. Это в равной степени верно, если вы нарисуете структуру цвиттер-иона вместо этой более простой структуры. Из-за этих четырех разных групп, присоединенных к одному и тому же атому углерода, аминокислоты (кроме глицина) являются хиральными . | ||
Важно: Если вы не знаете, что именно означает , перейдите по этой ссылке на страницу об оптической изомерии. Вы найдете оптическую активность аминокислот, обсуждаемую внизу этой страницы, но прочитайте всю страницу, чтобы убедиться, что вы понимаете, что происходит. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Отсутствие плоскости симметрии означает, что будет два стереоизомера аминокислоты (кроме глицина) — один является несовместимым зеркальным отображением другого. Изомеры обычной 2-аминокислоты: | ||
Примечание: Если вы не знаете, что означают различные символы облигаций, вы не должны заходить так далеко! Перейдите по указанной выше ссылке на страницу об оптической изомерии. 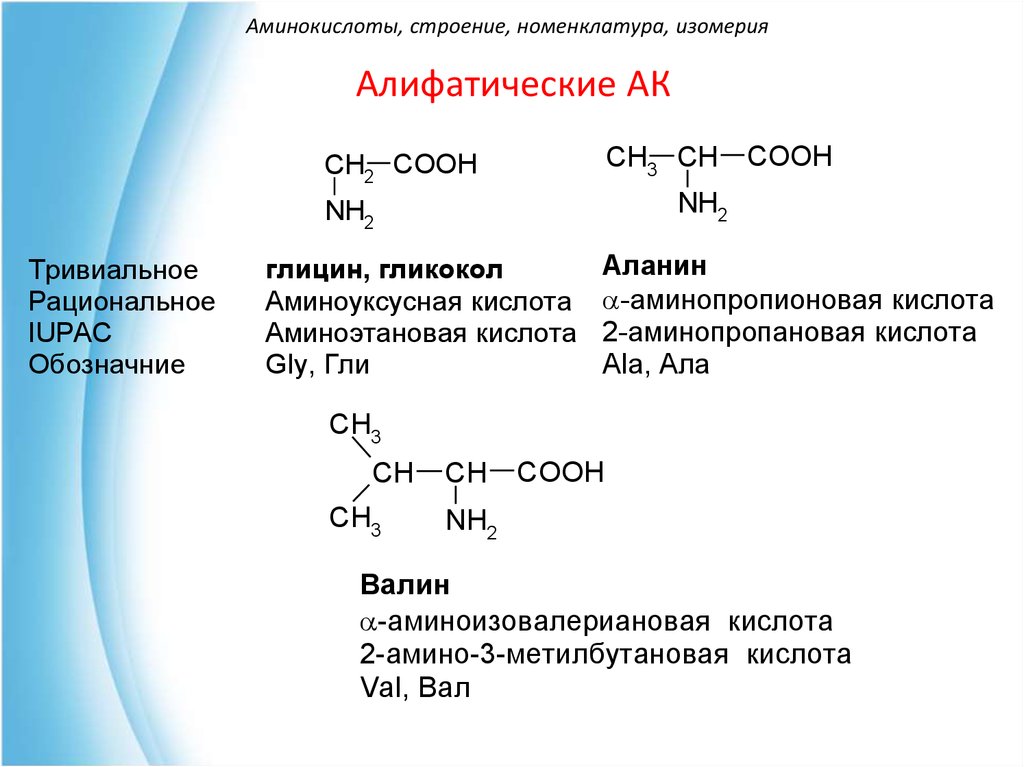 Прочтите эту страницу и перейдите по следующей ссылке на этой странице, чтобы нарисовать органические молекулы. Прочтите эту страницу и перейдите по следующей ссылке на этой странице, чтобы нарисовать органические молекулы. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Все встречающиеся в природе аминокислоты имеют правую структуру на этой диаграмме. Это известно как конфигурация «L-». Другая известна как конфигурация «D-». Вам почти наверняка не нужно знать это для целей химии уровня Великобритании A, но если вам интересно, вы можете распознать L-конфигурацию, представив, что вы смотрите сверху вниз на правую структуру на последней диаграмме. — , другими словами, с ближайшим к вам атомом водорода . Если вы прочитаете другие группы по часовой стрелке, вы получите слово МУКОЗУ. | ||
Предупреждение: Существуют различные другие способы решения этого вопроса, также основанные на слове CORN, но если посмотреть на молекулу с другой точки зрения, что может означать, что CORN следует наносить против часовой стрелки, а не по часовой стрелке для L- форма. 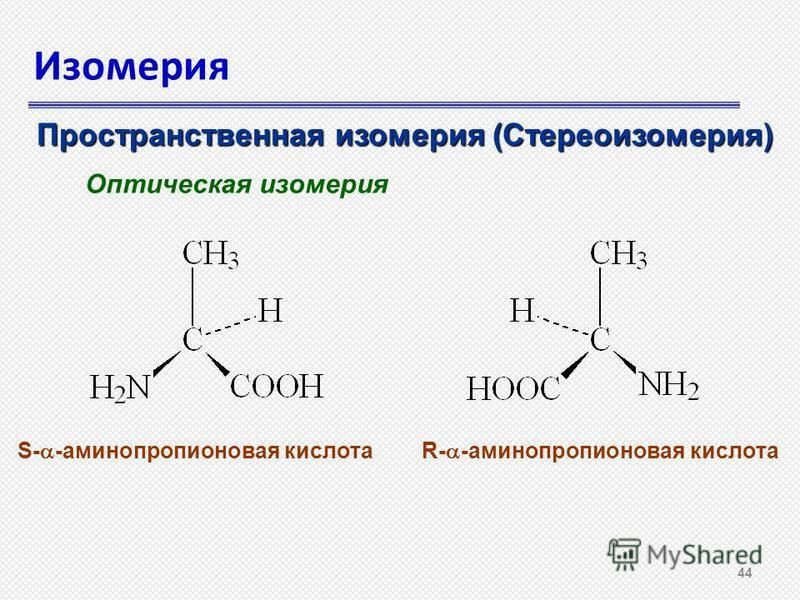 Если вы уже выучили другое правило, придерживайтесь его. Если вы изучаете химию на уровне A (или эквивалентном), выясните, чего (если вообще ожидают) ваши экзаменаторы, и узнайте об этом. Если вам не нужно об этом знать, забудьте об этом! | ||
Глядя на структуру, нельзя сказать, будет ли этот изомер вращать плоскость поляризации плоскополяризованного света по часовой стрелке или против часовой стрелки. Все встречающиеся в природе аминокислоты имеют одинаковую L-конфигурацию, но среди них есть примеры, которые вращают плоскость по часовой стрелке (+), и наоборот (-). Например:
Довольно часто природные системы работают только с одним из оптических изомеров (энантиомеров) оптически активного вещества, такого как аминокислоты. Нетрудно понять, почему это может быть. Поскольку молекулы имеют различное пространственное расположение своих различных групп, только одна из них, вероятно, правильно впишется в активные центры ферментов, с которыми они работают.
© Джим Кларк, 2004 г. (последнее изменение: апрель 2016 г.) | ||
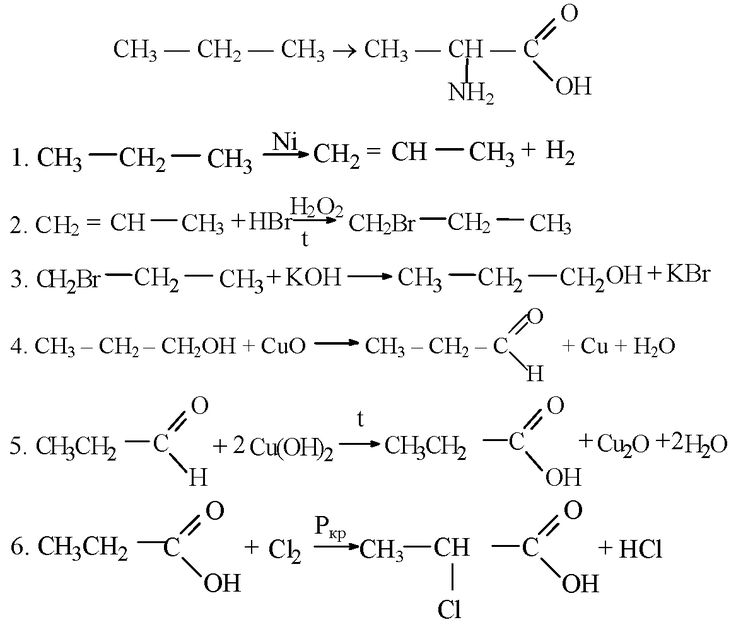
Преобразование пропановой кислоты в альфа-аланин (2-аминопропановую кислоту)
Вопрос
Обновлено: 26/04/2023 (ЧАСТЬ-II ОПИСАТЕЛЬНЫЕ ВОПРОСЫ) (ДЛИННЫЕ ОТВЕТЬТЕ НА ВОПРОСЫ)
21 видеоРЕКЛАМА
Text Solution
Проверено экспертами
Был ли этот ответ полезен?
388
Стенограмма
Иллюстрация вопрос: преобразовать паническую кислоту в альфа-батарея A9 — это пища с 2-аминопропановой кислотой, которую мы должны использовать, обновите, как у нас есть, прежде всего, на этой неделе кислота и 4, согласно обнаружению, что это простая, которая представляет собой пропановую кислоту, она будет называться альфа-углеродом и присутствовала в этом колледже KB.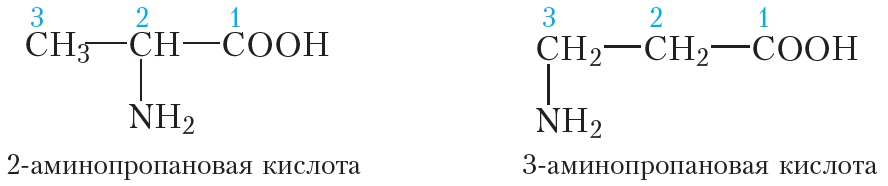 быть преобразован в алкан, но писатель использует красный фосфор с br2 Примечание H Я знал, что условия будут заменены падением, он превратится в альфа-бром Альфа-бром этот стенд пропановой кислоты
быть преобразован в алкан, но писатель использует красный фосфор с br2 Примечание H Я знал, что условия будут заменены падением, он превратится в альфа-бром Альфа-бром этот стенд пропановой кислоты
после этого мы можем использовать нуклеофил Nh4 непосредственно Nh4 и nf3 имеет долгий процесс, эта атака на этот углерод и эта книга будет освобождена отсюда как гостиная после этого Жесткие слова из этой модели также считаются уравновешивающими насилие этой статьи он будет преобразован в CS3 после этого у вас есть этот Ch на самом деле chcl3 а затем у нас есть Ch и в том, что у нас есть этот метод в прикрепленных группах прямо сейчас у нас есть в нем запускается в группе 1 жесткий освобождается отсюда и это будет сочетаться с этим годом, чтобы HBR был выпущен, это преобразование в актив, который называется 2-аминопропановой кислотой, подсчет MS начнется с вашего 12322 ABN Open. Надеюсь, вы понимаете это, спасибо
Ab Padhai каро бина объявления ке
Khareedo DN Pro и дехо сари видео бина киси объявление ки rukaavat ке!
Похожие видео
2-аминопропановая кислота
19382654
Преобразование пропановой кислоты в 2-бромпропановую кислоту.

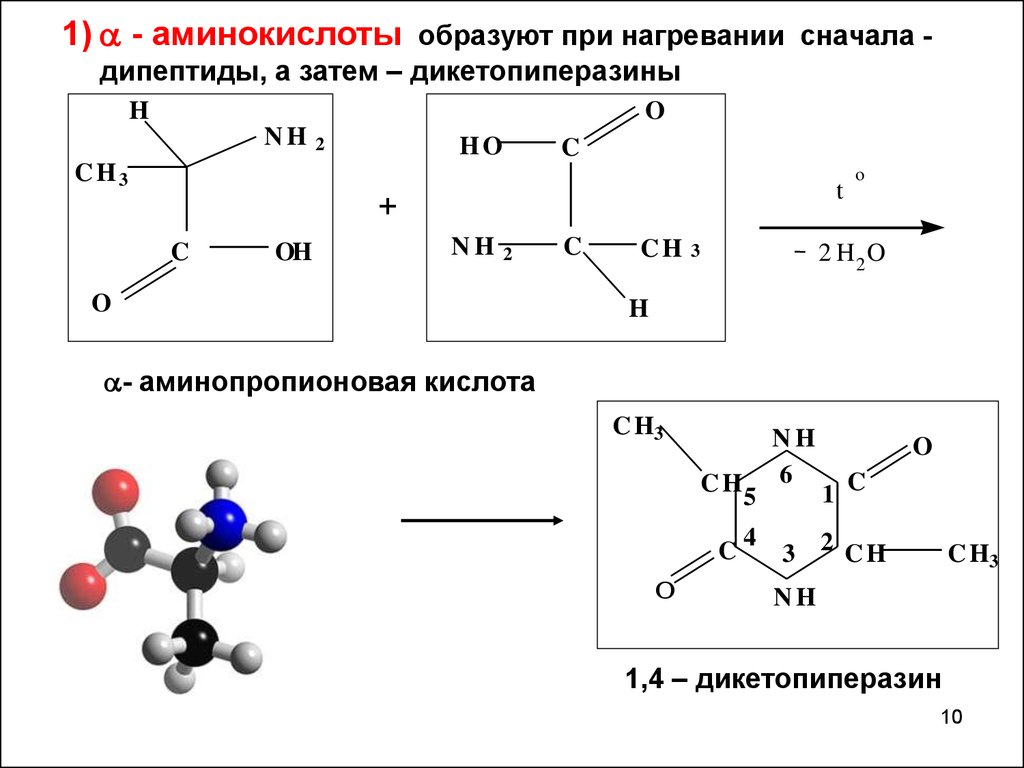
 В глицине группа «R» представляет собой еще один атом водорода.
В глицине группа «R» представляет собой еще один атом водорода.
