Однократное введение тестостерона не влияет на анаболические процессы в мышцах
Однократное введение тестостерона не влияет на кинетику аминокислот и не приводит к развитию анаболического эффекта в скелетных мышцах. Об этом сообщили специалисты из Университета медицинских наук Арканзаса (США), исследование которых было опубликовано в журнале Nutrition and Metabolism.
Хорошо известно, что экзогенный тестостерон влияет на анаболические процессы в мышцах и вызывает увеличение мышечной массы. Однако кинетические механизмы, лежащие в основе увеличения синтеза мышечного белка, описаны мало.
В предыдущем исследовании, проведенном Университетом медицинских наук Арканзаса, было показано, что баланс мышечного белка, измеренный натощак у здоровых мужчин сдвигается в положительную сторону спустя 5 дней с начала применения тестостерона. Синтез белка начинает протекать с более высокой скоростью, чем его распад.
Синтез белка начинает протекать с более высокой скоростью, чем его распад.
Но осталось неясным, оказывает ли тестостерон аналогичный эффект при однократном введении. Этот вопрос может быть актуальным для мужчин, которые не имеют показаний для клинического применения тестостерона, но периодически подвергаются острым катаболическим стрессам — например, военнослужающие, которые лишаются сна, испытывают дефицит энергии и неблагоприятные экологические воздействия в период тренировок или боевых действий. Стрессовые ситуации обычно продолжаются 3-60 дней и вызывают выраженное гипогонадное состояние и усиление катаболических процессов в мышцах. В таком контексте однократное применение тестостерона могло бы предотвратить потерю мышечной массы у мужчин.
Американские специалисты провели новое перекрестное исследование, чтобы изучить влияние однократного введения тестостерона на кинетику протеина в мышцах ног и транспорт селективно меченых аминокислот, используя артериовенозную балансовую модель и прямые измерения скоростей фракционного синтеза и распада белков в смешанных скелетных мышцах.
Участие в исследовании приняли 4 здоровых мужчины. В первой фазе двое были рандомизированы на получение тестостерона (30 мг), двое — на введение интралипида. Растворы вводились в течение 5 часов со скоростью 0,25 мг·мин− 1. Учитывая, что в организме здорового мужчины вырабатывается 3,8-9,1 мг тестостерона в сутки, участники получали супрафизиологические дозы препарата. Во второй фазе (спустя 5 дней) пациентов поменяли местами: группа, получавшая ранее тестостерон, была переведена на интралипид, а получавшая интралипид — на тестостерон. В обеих фазах одновременно на протяжении 5 часов пациентам вводили изотопно-меченые аминокислоты. По анализам крови и результатам биопсии латеральной широкой мышцы бедра определялись скорость синтеза и распада белка.
Результаты исследования показали, что после введения тестостерона метаболизм белка не менялся. Препарат минимально влиял на кинетику аминокислот, незначительно уменьшая выход аминокислот из мышц и усиливая окисление лейцина в мышечных клетках.
Авторы заключили, что тестостерон не оказывает немедленного воздействия на метаболизм белка в мышцах. Поэтому остается неопределенность в отношении того, в какой период с начала применения препарата начинают развиваться его анаболические эффекты.
Источник: Nutr Metab (Lond). 2019 Aug 22;16:56. doi: 10.1186/s12986-019-0385-0. eCollection 2019.
Тематики и теги
Тестостерон
Для отправки комментариев необходимо войти или зарегистрироваться
Остеоартроз: современное состояние проблемы и тактика лечения. Интервью
Остеоартроз относится к группе первично невоспалительных заболеваний суставов различной этиологии и может рассматриваться как анатомо–клинический синдром, который характеризуется болью механического типа у лиц старше 45 лет с соответствующими рентгенологическими данными.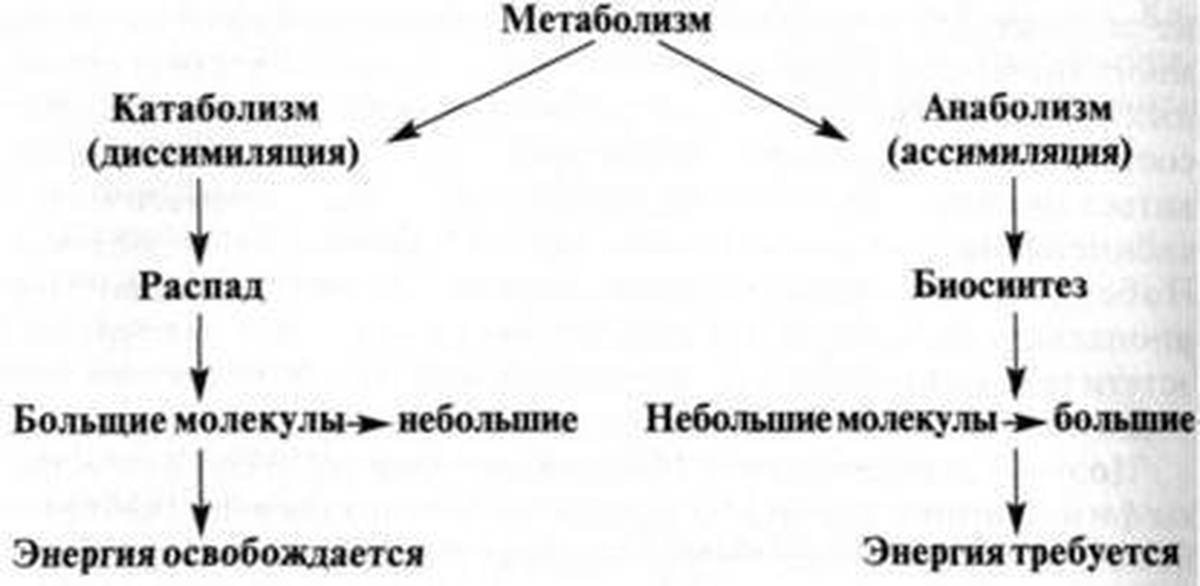 Существует и другое определение, согласно которому остеоартроз – группа патогенетически близких заболеваний, имеющих различную этиологию, но приводящих к однотипному биохимическому и клиническому исходу, характеризующемуся прогрессивной потерей гиалинового хряща и ремоделированием субхондральной кости.
Существует и другое определение, согласно которому остеоартроз – группа патогенетически близких заболеваний, имеющих различную этиологию, но приводящих к однотипному биохимическому и клиническому исходу, характеризующемуся прогрессивной потерей гиалинового хряща и ремоделированием субхондральной кости.
Какова распространенность этого заболевания?
Остеоартроз относится к наиболее часто встречающимся заболеваниям, его распространенность четко связана с возрастом и полом. Практически у каждого второго больного старше 50 лет имеются клинические или рентгенологические его признаки, а среди лиц старше 75 лет остеоартроз выявляется у всех без исключения. Это заболевание существенно чаще встречается у женщин, чем у мужчин, что относится к любой его локализации. У женщин наблюдается и более яркая как рентгенологическая, так и клиническая симптоматика остеоартроза.
Каковы первичные патогенетические признаки остеоартроза?
К их числу относятся недостаточный синтез протеогликанов и фрагментация протеогликановых агрегатов, усиление катаболических процессов, экспрессия супероксидных радикалов, активация коллагеназы и фосфолипазы А2, редуцированный синтез гиалуроновой кислоты, а также гиперпродукция провоспалительных цитокинов – интерлейкина (ИЛ)–1 и фактора некроза опухоли (ФНО)–α.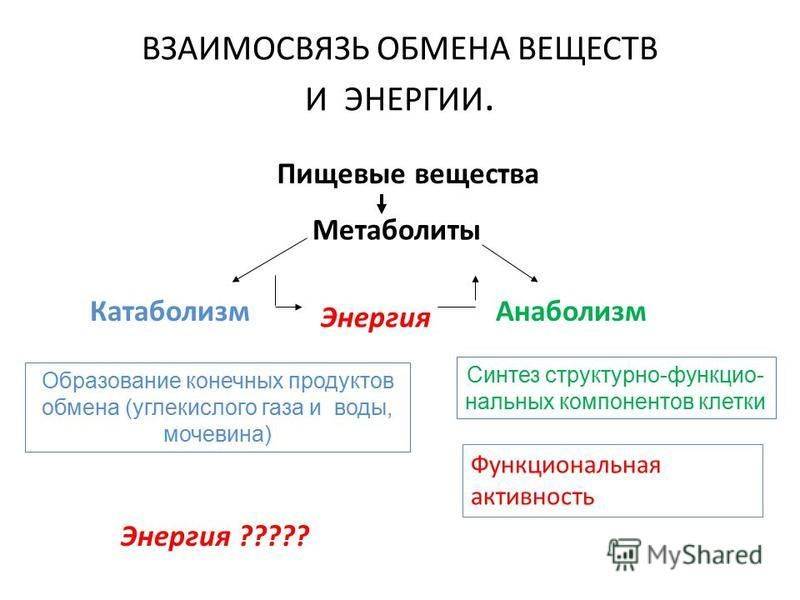
Что лежит в основе развития остеоартроза?
Остеоартроз развивается в тех случаях, когда хрящ и субхондральная кость не способны адекватно противостоять механической нагрузке, что связано с ограничением репаративных возможностей этих тканей. Основным плацдармом развития патологических изменений является гиалиновый хрящ, в котором происходит не только уменьшение количества хондроцитов, но и снижение их метаболической активности. Это приводит к снижению синтеза коллагена в матриксе хряща и сульфатированных протеогликанов – хондроитина сульфата, кератана сульфата, протеогликан–гиалуроновых агрегатов, а также гиалуроновой кислоты.
Наиболее важной составляющей этих изменений является дефицит синтеза протеогликанов, основного структурного компонента матрикса хряща. При остеоартрозе не только снижается количественный синтез протеогликанов, но и изменяется качественный их состав, а именно выработка полноценных протеогликанов с высокой молекулярной массой.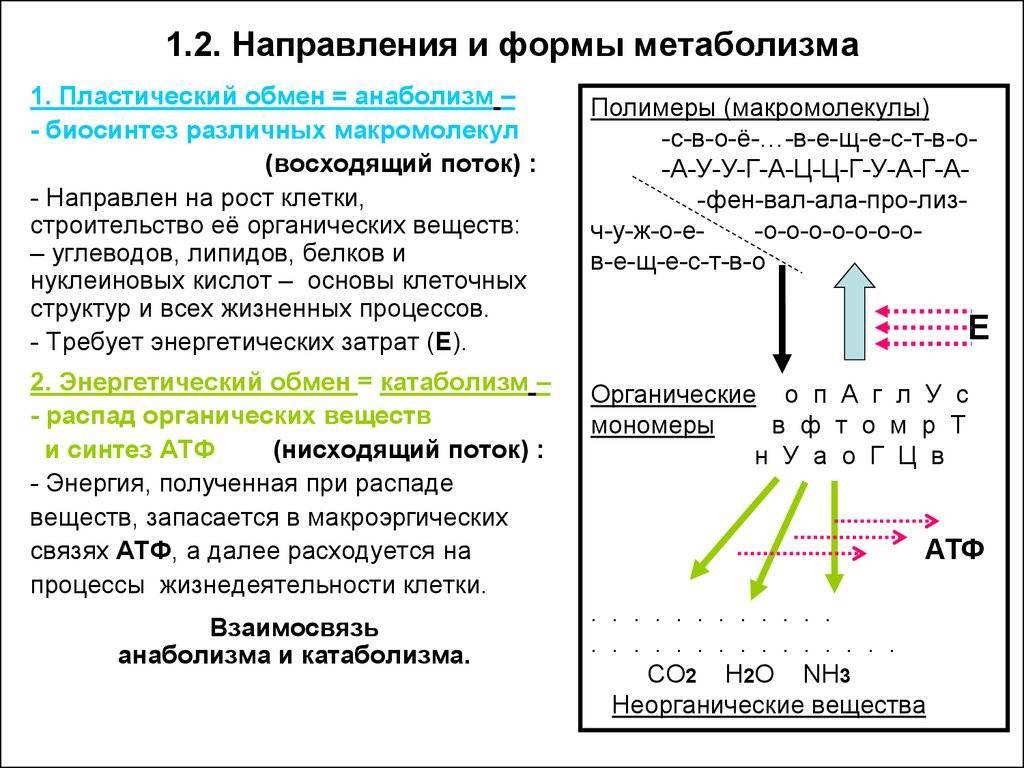
Важную роль в развитии морфологических изменений играет экспрессия цитокинов, прежде всего ИЛ–1 и ФНО–α. Провоспалительные цитокины угнетают образование матрикса хряща, стимулируют синтез металлопротеиназ и снижают продукцию тканевых ингибиторов матриксных протеиназ. Значение ИЛ–1 в патогенезе остеоартроза определяется активацией синовиальных клеток, остеокластов и хондроцитов, что в конечном счете приводит к воспалению, деградации субхондральной кости и ее репаративным изменениям, как и деградации хряща.
С другой стороны, при остеоартрозе имеет место дефицит противовоспалительных цитокинов, например трансформирующего фактора роста–β и ингибитора плазминогена–1, которые ингибируют анаболические процессы в пораженном хряще.
 Определенную роль в патогенетическом каскаде остеоартроза выполняют супероксидные радикалы, уменьшение синтеза синовиоцитами гиалуроновой кислоты, а также гиперпродукция простагландина Е2, что, наряду с другими факторами, способствует воспалению в тканях сустава и индуцирует фибропластическую дегенерацию хряща.
Определенную роль в патогенетическом каскаде остеоартроза выполняют супероксидные радикалы, уменьшение синтеза синовиоцитами гиалуроновой кислоты, а также гиперпродукция простагландина Е2, что, наряду с другими факторами, способствует воспалению в тканях сустава и индуцирует фибропластическую дегенерацию хряща.Морфологические изменения при этом заболевании включают уменьшение массы гиалинового хряща, субхондральный склероз кости с гипертрофической реакцией, ремодуляцию субхондральной кости с образованием краевых остеофитов. На раннем этапе заболевания происходит отек внеклеточного матрикса, появляются зоны количественного уменьшения хондроцитов, которые затем сменяются очагами их пролиферации. Позже формируются микротрещины во внеклеточном матриксе хряща и деструкция субхондральной кости.
 В субхондральной кости формируется остеоид, который активно минерализуется, происходит образование субхондральных кист, микропереломов, и все это приводит к субхондральному склерозу, одному из характерных признаков остеоартроза. Полагают, что изменения в субхондральной кости предшествуют дегенерации гиалинового хряща, при этом костные ростковые факторы играют значительную роль в ремоделировании кости и формировании остеофитов. Специфические изменения архитектоники субхондральной трабекулярной кости являются следствием ускоренного костного метаболизма и приводят к развитию остеофитов, поверхность которых покрыта фибриллярным хрящом.
В субхондральной кости формируется остеоид, который активно минерализуется, происходит образование субхондральных кист, микропереломов, и все это приводит к субхондральному склерозу, одному из характерных признаков остеоартроза. Полагают, что изменения в субхондральной кости предшествуют дегенерации гиалинового хряща, при этом костные ростковые факторы играют значительную роль в ремоделировании кости и формировании остеофитов. Специфические изменения архитектоники субхондральной трабекулярной кости являются следствием ускоренного костного метаболизма и приводят к развитию остеофитов, поверхность которых покрыта фибриллярным хрящом.При остеоартрозе преобладают дегенеративные изменения, но неменьшее значение в развитии этого заболевания имеет воспаление, которое локализуется в синовиальной мембране, хряще, субхондральной кости и периартикулярных мягких тканях. Персистирующее воспаление синовии сопровождается неспецифической лимфоплазматической и гистиоцитарной инфильтрацией, а также сверхэкспрессией провоспалительных медиаторов.

Остеоартроз рассматривается как гетерогенное заболевание. Какие имеются доказательства этого?
Остеоартроз – мультифакториальное заболевание, развитию которого способствуют механические, гормональные и генетические факторы риска. Их вклад в развитие, отдельные проявления и исход этого заболевания у конкретных больных чрезвычайно вариабелен. Хорошо известно, что в развитии гонартроза, коксартроза и артроза мелких суставов кистей принимают участие как общие, так и отличительные факторы. Это дало возможность рассматривать остеоартроз как гетерогенную группу заболеваний суставов различной этиологии, но со сходными биологическими, морфологическими и клиническими признаками и общим исходом. Гетерогенность остеоартроза находит свое отображение в основных его формах, преимущественной локализации патологического процесса, клинической презентации, характере течения, темпах прогрессирования, факторах риска развития и прогрессирования.
 Первичный остеоартроз развивается в ранее неизмененных суставах под влиянием различных факторов, способствующих первичному нарушению метаболизма хрящевой ткани, а вторичный – является следствием ранее имевшихся заболеваний опорно–двигательного аппарата. Этиологические факторы развития вторичного остеоартроза – метаболические заболевания (микрокристаллические артропатии – подагра и пирофосфатная артропатия, акромегалия, охроноз, гемохроматоз, болезнь Вильсона), анатомические аномалии (эпифизеальная дисплазия, врожденный вывих бедра, болезнь Blount и Legg–Perthe), воспалительные заболевания (любая воспалительная артропатия, септический артрит), острая или хроническая травма («большая травма суставов», костные переломы в пределах сустава или в близлежащей области, остеонекроз, менискэктомия или какие– либо другие операции на суставах, профессиональные травмы). Не всегда легко идентифицировать форму остеоартроза, так как взаимосвязь между этиологическими и предрасполагающими факторами установить не удается.
Первичный остеоартроз развивается в ранее неизмененных суставах под влиянием различных факторов, способствующих первичному нарушению метаболизма хрящевой ткани, а вторичный – является следствием ранее имевшихся заболеваний опорно–двигательного аппарата. Этиологические факторы развития вторичного остеоартроза – метаболические заболевания (микрокристаллические артропатии – подагра и пирофосфатная артропатия, акромегалия, охроноз, гемохроматоз, болезнь Вильсона), анатомические аномалии (эпифизеальная дисплазия, врожденный вывих бедра, болезнь Blount и Legg–Perthe), воспалительные заболевания (любая воспалительная артропатия, септический артрит), острая или хроническая травма («большая травма суставов», костные переломы в пределах сустава или в близлежащей области, остеонекроз, менискэктомия или какие– либо другие операции на суставах, профессиональные травмы). Не всегда легко идентифицировать форму остеоартроза, так как взаимосвязь между этиологическими и предрасполагающими факторами установить не удается. Некоторые предрасполагающие факторы, играющие ключевую роль в развитии вторичного остеоартроза, могут иметь определенное значение и при первичном.
Некоторые предрасполагающие факторы, играющие ключевую роль в развитии вторичного остеоартроза, могут иметь определенное значение и при первичном.Гетерогенность остеоартроза проявляется и в преимущественной локализации патологического процесса. При этом заболевании поражаются дистальные межфаланговые суставы кистей, первые запястно–пястные, коленные, тазобедренные и межпозвонковые (фасеточные) суставы. Обычно в патологический процесс вовлекается несколько суставов, причем наблюдается более выраженная ассоциация между контрлатеральными суставами, чем между суставами других групп. Остеоартроз коленных и тазобедренных суставов нередко сопровождается и остеоартрозом суставов кистей, причем корреляция с коленными суставами более характерна. При первичном остеоартрозе лучезапястные, локтевые и плечевые суставы, как правило, в патологический процесс не вовлекаются, но они могут быть поражены при вторичном остеоартрозе.
Какие факторы риска имеют значение в развитии остеоартроза и его прогрессировании?
Определение факторов риска развития и прогрессирования остеоартроза имеет прямое отношение к первичной и вторичной его профилактике. Эти факторы подразделяются на модифицированные, которые могут быть подвергнуты коррекции, и немодифицированные, активно воздействовать на которые невозможно. Наибольшее значение среди немодифицированных факторов имеют пол, возраст больных, врожденные нарушения (гипермобильность, дисплазия, нестабильность) и генетические факторы, включая патологию гена коллагена II типа, семейную агрегацию остеоартроза. Генетические ассоциации при остеоартрозе пока трудно интерпретировать, но все же идиопатический остеоартроз можно рассматривать с позиций полигенного заболевания с различными фенотипами. При генерализованном остеоартрозе выявлен полиморфизм гена II типа коллагена (COL2A1), локализующегося на 12 хромосоме, а также гены полиморфизма ИЛ–1 и ИЛ–1RA, определяющие высокий уровень секреции ИЛ–1 и низкий – ИЛ–1RA.
Эти факторы подразделяются на модифицированные, которые могут быть подвергнуты коррекции, и немодифицированные, активно воздействовать на которые невозможно. Наибольшее значение среди немодифицированных факторов имеют пол, возраст больных, врожденные нарушения (гипермобильность, дисплазия, нестабильность) и генетические факторы, включая патологию гена коллагена II типа, семейную агрегацию остеоартроза. Генетические ассоциации при остеоартрозе пока трудно интерпретировать, но все же идиопатический остеоартроз можно рассматривать с позиций полигенного заболевания с различными фенотипами. При генерализованном остеоартрозе выявлен полиморфизм гена II типа коллагена (COL2A1), локализующегося на 12 хромосоме, а также гены полиморфизма ИЛ–1 и ИЛ–1RA, определяющие высокий уровень секреции ИЛ–1 и низкий – ИЛ–1RA.
Для отдельных клинических форм остеоартроза имеются как общие факторы риска, характерные для любой локализации этого заболевания, так и присущие только им. Факторами риска развития гонартроза являются пожилой возраст, женский пол, длительная и значительная физическая перегрузка суставов, интенсивные спортивные нагрузки, ожирение, травмы в анамнезе, гормональная заместительная терапия, дефицит витамина D, нарушение конгруэнтности суставных поверхностей (вальгусная или варусная деформация), слабость черырехглавой мышцы, механические факторы (гипермобильный синдром, нарушение проприоцепции, врожденные дефекты), курение, а также метаболические заболевания суставов и эндокринная патология (сахарный диабет, гиперпаратиреоидизм, гипотиреоидизм).
Немаловажное значение имеет плоскостопие, которое значительно повышает нагрузку на коленный сустав и способствует прогрессированию гонартроза. Значительная механическая перегрузка суставов (механический стресс) вызывает экспрессию металлопротеиназ и цитокинов посредством активации механорецепторов хондроцитов, в то время как умеренная интермиттирующая нагрузка стимулирует синтез матрикса хряща. К факторам риска быстрого прогрессирования остеоартроза коленных суставов, помимо вышеперечисленных, относят диету с низким содержанием витаминов С и D3, а также синовит и субхондральный отек кости (МРТ).
Что касается узелкового остеоартроза кисти, то в качестве факторов его развития рассматриваются пожилой возраст, сила сжатия кисти, индекс массы тела, характер труда и интенсивные спортивные нагрузки, а факторы его прогрессирования до последнего времени не определены. Для развития коксартроза большое значение имеет врожденная дисплазия тазобедренного сустава с особенностями строения как головки бедра, так и вертлужной впадины.
Каковы основные принципы рациональной терапии остеоартроза?
Терапия остеоартроза предусматривает активное воздействие на основные симптомы заболевания (боль и ограничение подвижности суставов), а также замедление его прогрессирования, снижение риска обострений и вовлечения ранее интактных суставов, что в конечном итоге приводит к улучшению качества жизни пациентов, предотвращению стойких деформаций суставов и инвалидности.
В чем заключаются основные трудности терапии остеоартроза?
Прежде всего в необходимости длительного и практически постоянного лечения. Не всегда проводимая терапия приводит к положительным результатам, что связано с хроническим неуклонно прогрессирующим течением остеоартроза подчас без каких–либо значимых факторов риска. С другой стороны, больные с остеоартрозом – как правило, люди пожилого возраста, у которых наблюдаются многочисленные соматические заболевания, требующие проведения cоответствующего лечения, что приводит к полипрагмазии. У лиц пожилого возраста следует предусмотреть возможность развития неблагоприятных эффектов фармакотерапии даже на низкие дозы препаратов или обострения сопутствующих заболеваний.
У лиц пожилого возраста следует предусмотреть возможность развития неблагоприятных эффектов фармакотерапии даже на низкие дозы препаратов или обострения сопутствующих заболеваний.
Какова наиболее актуальная задача терапии остеоартроза?
Это устранение прогрессирования остеоартроза или существенное замедление его темпов, что достигается назначением симптом–модифицирующих препаратов медленного действия, ранее рассматриваемых в качестве хондропротективных.
Какие препараты относятся к этой группе фармакологических агентов?
К этой группе препаратов относятся хондроитин сульфат, глюкозамин сульфат, глюкозамин гидрохлорид, диацереин, неомыляемые соединения сои и авокадо, гиалуроновая кислота, а также комбинированные препараты, в состав которых входят хондроитин сульфат и гликозамин сульфат или гидрохлорид, стандартизированные препараты некоторых видов имбиря, антирезорбтивные препараты, широко применяющиеся в терапии остеопороза. Назначение последних при остеоартрозе объясняется воздействием на субхондральную кость.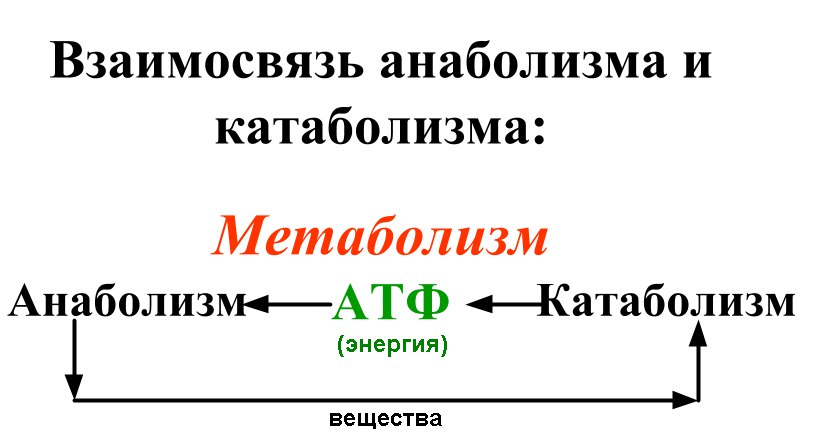 Согласно международным рекомендациям 2008 г. (ACR, EULAR), только хондроитин сульфат, глюкозамин сульфат, диацереин, гиалуроновая кислота, неомыляемые соединения сои и авокадо следует рассматривать с позиций доказательной медицины. Они способны оказывать не только симптом–модифицирующее действие за счет опосредованного противовоспалительного эффекта, но и структурно–модифицирующее. Эти препараты уменьшают интенсивность боли в суставах, улучшают их функцию, а также задерживают или приостанавливают прогрессирование остеоартроза.
Согласно международным рекомендациям 2008 г. (ACR, EULAR), только хондроитин сульфат, глюкозамин сульфат, диацереин, гиалуроновая кислота, неомыляемые соединения сои и авокадо следует рассматривать с позиций доказательной медицины. Они способны оказывать не только симптом–модифицирующее действие за счет опосредованного противовоспалительного эффекта, но и структурно–модифицирующее. Эти препараты уменьшают интенсивность боли в суставах, улучшают их функцию, а также задерживают или приостанавливают прогрессирование остеоартроза.
В чем заключается биологическая активность данных препаратов?
Эти препараты стимулируют синтез хондроцитами макромолекул матрикса хряща, прежде всего гликозаминогликанов, протеогликанов и аггрекана, способствуют нарастанию синтеза коллагена II типа и гиалуроновой кислоты, моделируют пролиферацию хондроцитов, обладают свойствами антиоксидантов и тем самым блокируют образование супероксидных радикалов, ингибируют экспрессию ИЛ–1 и подавляют синтез оксида азота. Они снижают активность лизосомальных ферментов, активируют анаболические процессы в матриксе хряща, замедляют дегенерацию хрящевой ткани и восстанавливают ее структуру, повышают резистентность хондроцитов к воздействию провоспалительных цитокинов и негативным эффектам нестероидных противовоспалительных препаратов (НПВП) на метаболизм хряща.
Они снижают активность лизосомальных ферментов, активируют анаболические процессы в матриксе хряща, замедляют дегенерацию хрящевой ткани и восстанавливают ее структуру, повышают резистентность хондроцитов к воздействию провоспалительных цитокинов и негативным эффектам нестероидных противовоспалительных препаратов (НПВП) на метаболизм хряща.
Эту группу препаратов характеризуют медленное развитие лечебного действия, обычно наступающее после 2–4 недель от начала терапии и позже, выраженное последействие с сохранением улучшения в течение 4–6 месяцев после прекращения их приема, хорошая переносимость и высокая безопасность.
Какие симптоматические препараты медленного действия являются наиболее эффективными?
Первостепенное значение в лечении остеоартроза принадлежит естественным компонентам хрящевого межклеточного вещества – хондроитину сульфату и глюкозамину сульфату, которые являются наиболее изученными среди препаратов этой группы и имеют солидную доказательную базу.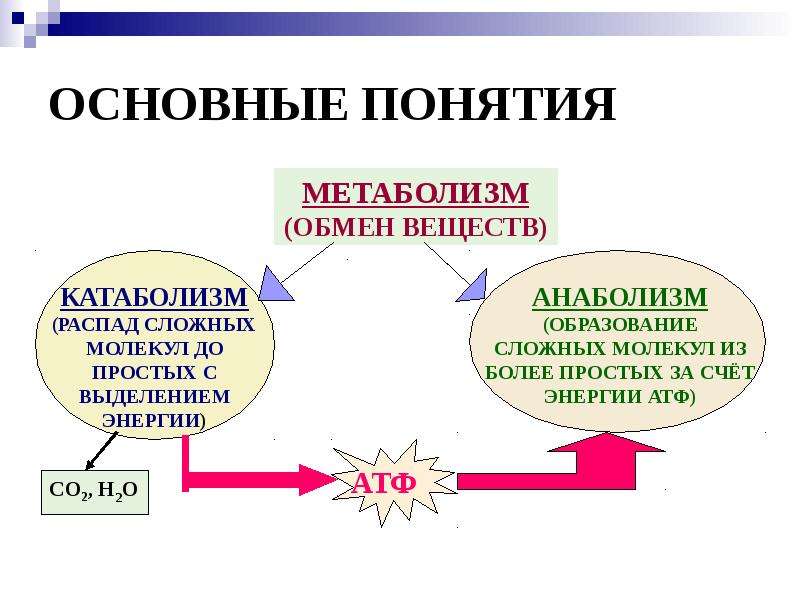 Эти симптом–модифицирующие препараты медленного действия относят к структурным аналогам хряща. Они обладают специфическими противоартрозными свойствами, причем не только активно воздействуют на основные клинические проявления этого заболевания – боль и функцию пораженных суставов, но и замедляют темпы прогрессирования остеоартроза, нормализуют или стабилизируют структурные изменения в гиалиновом хряще, предупреждают изменения в непораженном суставе.
Эти симптом–модифицирующие препараты медленного действия относят к структурным аналогам хряща. Они обладают специфическими противоартрозными свойствами, причем не только активно воздействуют на основные клинические проявления этого заболевания – боль и функцию пораженных суставов, но и замедляют темпы прогрессирования остеоартроза, нормализуют или стабилизируют структурные изменения в гиалиновом хряще, предупреждают изменения в непораженном суставе.
Среди других препаратов Вы первым называете хондроитин сульфат. Какова эффективность его применения?
Хондроитин сульфат также относится к структурным аналогам хряща и выступает, наряду с глюкозамином, в качестве основного противоартрозного препарата. Он рекомендован EULAR и OARSI для лечения остеоартроза коленных (2007), тазобедренных (2007) суставов и суставов кистей (2006). Хондроитин сульфат входит в состав основного вещества хрящевой ткани. По своей фармакологической активности он обладает выраженными симптом–модифицирующими свойствами, способствует разрешению вторичного синовита, тормозит прогрессирование остеоартроза (доказанный хондропротективный эффект), активирует катаболические и подавляет анаболические процессы. Биологическая активность хондроитина сульфата не ограничивается только его воздействием на хрящ и субхондральную кость у больных остеоартрозом. Малые его фрагменты обладают нейропротективными свойствами при болезни Альцгеймера и нарушениях мозгового кровообращения. Он уменьшает высыпания плантарного псориаза, а в эксперименте тормозит развитие атеросклероза аорты. При его применении наблюдается умеренное снижение концентрации холестерина и триглицеридов в плазме крови.
Биологическая активность хондроитина сульфата не ограничивается только его воздействием на хрящ и субхондральную кость у больных остеоартрозом. Малые его фрагменты обладают нейропротективными свойствами при болезни Альцгеймера и нарушениях мозгового кровообращения. Он уменьшает высыпания плантарного псориаза, а в эксперименте тормозит развитие атеросклероза аорты. При его применении наблюдается умеренное снижение концентрации холестерина и триглицеридов в плазме крови.
Хондроитин сульфат по своей химической структуре относится к сложным мукополисахаридам. Он стимулирует синтез протеогликанов, образование эндогенной гиалуроновой кислоты и коллагена типа II, замедляет деструкцию хряща за счет снижения активности ферментов и стимулирует процессы регенерации суставной ткани. Его влияние на хрящ определяется ингибицией энзимов деструкции хряща ММР – 3, 9, 13, 14, эластазы, катепсина–β, медиаторов воспаления – ЦОГ–2, простогландина, NF–kB, снижением синтеза оксида азота и свободных радикалов, угнетением апоптоза хондроцитов. Кроме того, он угнетает экспрессию ИЛ–1β хондроцитами и синовиоцитами и снижает концентрацию провоспалительных молекул (СРБ, ИЛ–6). Благодаря наличию карбоксильной и сульфатной групп хондроитин сульфат обладает выраженной гидрофобностью, а это, в свою очередь, способствует нормальному функционированию хряща и сохранению им эластических свойств. При приеме внутрь он в высоких концентрациях определяется в синовиальной жидкости. Этот препарат определяет вязкость синовиальной жидкости и эластичность хряща, несет отрицательный заряд и с катионами воды образует так называемое «давление набухания» – сопротивление сжатию, что имеет большое значение в осуществлении хрящом его механической функции. Кроме того, он обусловливает внутренний тонус хряща, улучшает трофику и уменьшает резорбцию субхондральной кости.
Кроме того, он угнетает экспрессию ИЛ–1β хондроцитами и синовиоцитами и снижает концентрацию провоспалительных молекул (СРБ, ИЛ–6). Благодаря наличию карбоксильной и сульфатной групп хондроитин сульфат обладает выраженной гидрофобностью, а это, в свою очередь, способствует нормальному функционированию хряща и сохранению им эластических свойств. При приеме внутрь он в высоких концентрациях определяется в синовиальной жидкости. Этот препарат определяет вязкость синовиальной жидкости и эластичность хряща, несет отрицательный заряд и с катионами воды образует так называемое «давление набухания» – сопротивление сжатию, что имеет большое значение в осуществлении хрящом его механической функции. Кроме того, он обусловливает внутренний тонус хряща, улучшает трофику и уменьшает резорбцию субхондральной кости.
Уровень доказательности хондроитина сульфата в плане модификации симптомов остеоартроза является высоким (IA), что отразилось в рекомендациях EULAR. Это его свойство нашло убедительные доказательства при мета–анализе большого количества контролированных клинических исследований с участием более 1000 больных с остеоартрозом коленных и тазобедренных суставов. В России самые многочисленные клинические исследования по хондроитину сульфату основаны на опыте применения препарата Структум. Эффективность хондроитина сульфата оказалась достоверно выше, чем эффективность плацебо по таким показателям, как интенсивность боли по ВАШ, индексу Лекена, скорости прохождения определенного расстояния, потребности в парацетамоле и НПВП, глобальной оценке результатов лечения больным. Достоверные изменения претерпевали все шкалы индекса WOMAC (боли, скованности, функции).
В России самые многочисленные клинические исследования по хондроитину сульфату основаны на опыте применения препарата Структум. Эффективность хондроитина сульфата оказалась достоверно выше, чем эффективность плацебо по таким показателям, как интенсивность боли по ВАШ, индексу Лекена, скорости прохождения определенного расстояния, потребности в парацетамоле и НПВП, глобальной оценке результатов лечения больным. Достоверные изменения претерпевали все шкалы индекса WOMAC (боли, скованности, функции).
В этих исследованиях анализировалась и переносимость препарата, которая оказалась хорошей, в целом она была такой же, как переносимость плацебо. Единичные нежелательные явления включали незначительную гастроинтестинальную токсичность (боли в животе у небольшого процента больных, диарею, запоры), а также кожные симптомы. Нежелательные явления обычно проходили без какой–либо коррекции дозы препарата и не требовали отмены или прекращения лечения.
Структурно–модифицирующие свойства хондроитина сульфата прослежены в рандомизированных исследованиях.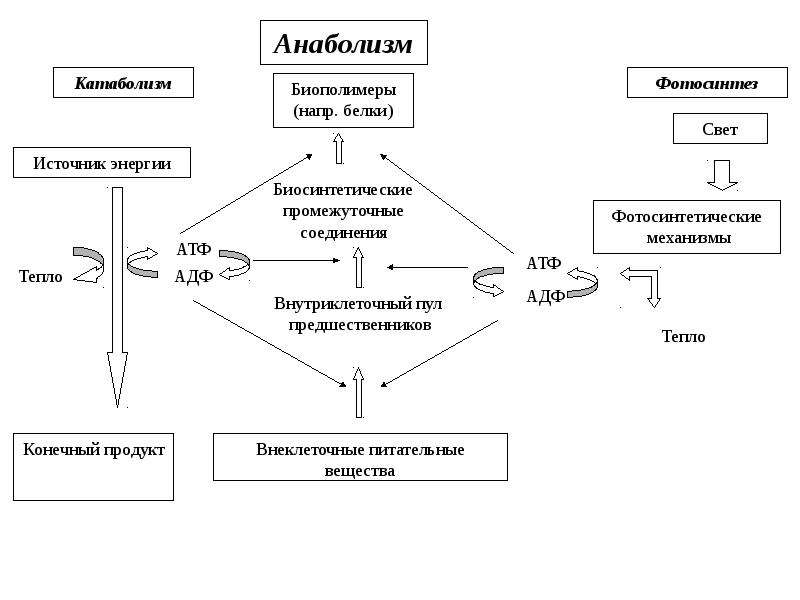 В одном из таких наблюдений (исследование STOPP, 2009) 622 больных гонартрозом принимали хондроитин сульфат per os (основная группа) или плацебо (контрольная группа). В основной группе зарегистрировано менее выраженное сужение суставной щели по сравнению с контрольной (–0,07 и 0,31 мм соответственно, р<0,0005), меньше было больных с рентгенологическим прогрессированием ≥0,25 мм по сравнению с плацебо (28 и 41% соответственно, р<0,0005). В этом исследовании не было выявлено различий в частоте и выраженности нежелательных явлений как в основной, так и в контрольной группе. О положительном действии ХС (Структум) свидетельствуют данные Л.И. Алексеевой. После 6–месячного курса терапии хондроитином per os в течение года достоверно снизилось число обострений остеоартроза и госпитализаций, связанных с этими обострениями, количество амбулаторных обращений и случаев временной потери трудоспособности.
В одном из таких наблюдений (исследование STOPP, 2009) 622 больных гонартрозом принимали хондроитин сульфат per os (основная группа) или плацебо (контрольная группа). В основной группе зарегистрировано менее выраженное сужение суставной щели по сравнению с контрольной (–0,07 и 0,31 мм соответственно, р<0,0005), меньше было больных с рентгенологическим прогрессированием ≥0,25 мм по сравнению с плацебо (28 и 41% соответственно, р<0,0005). В этом исследовании не было выявлено различий в частоте и выраженности нежелательных явлений как в основной, так и в контрольной группе. О положительном действии ХС (Структум) свидетельствуют данные Л.И. Алексеевой. После 6–месячного курса терапии хондроитином per os в течение года достоверно снизилось число обострений остеоартроза и госпитализаций, связанных с этими обострениями, количество амбулаторных обращений и случаев временной потери трудоспособности.
Существуют ли другие лекарственные формы хондроитина сульфата?
В настоящее время в клиническую практику вводится новая лекарственная форма хондроитина сульфата в инъекционной форме – Хондрогард (компания «Сотекс»). Хондрогард является раствором для внутримышечного введения. В 1 ампуле (1 мл) содержится 100 мг хондроитина сульфата натрия. Раствор обладает более высокой биодоступностью по сравнению с таблетированными формами.
Хондрогард является раствором для внутримышечного введения. В 1 ампуле (1 мл) содержится 100 мг хондроитина сульфата натрия. Раствор обладает более высокой биодоступностью по сравнению с таблетированными формами.
Фармакодинамические особенности Хондрогарда заключаются в следующем: уже спустя 30 минут после внутримышечного введения этот препарат обнаруживается в значительной концентрации в крови, достигая максимальных значений через 60 минут. В то же время уже через 15 минут после внутримышечного введения хондроитин сульфат выявляется в синовиальной жидкости, затем накапливается в гиалиновом хряще и достигает максимальной концентрации через 2 суток. Таким образом, синовиальная оболочка не является препятствием для проникновения препарата в полость сустава. Однако следует отметить, что накапливается хондроитин сульфат главным образом в хрящевой ткани суставов.
Курс лечения препаратом Хондрогард составляет 25–30 инъекций, при этом препарат вводится через день по 2 мл (200 мг ХС).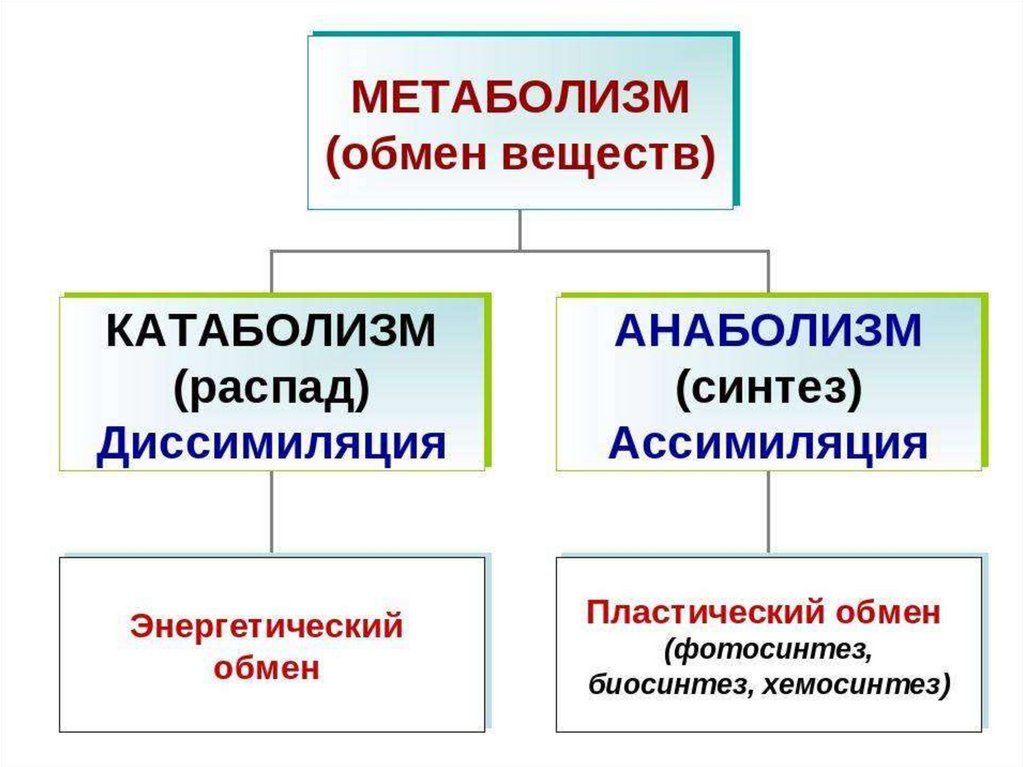 В отличие от других инъекционных форм ХС Хондрогард не требует дополнительного разведения, т.к. выпускается в форме раствора, что несомненно, удобно.
В отличие от других инъекционных форм ХС Хондрогард не требует дополнительного разведения, т.к. выпускается в форме раствора, что несомненно, удобно.
Учитывая, что эффективность действующего вещества препарата – хондроитина сульфата широко изучена многочисленными исследователями, полагаю, что отечественный препарат Хондрогард займет достойное место в арсенале симптоматических средств замедленного действия.
Каковы перспективы разработки других лекарственных средств для борьбы с остеоартрозом?
Следует полагать, что в дальнейшем будет развиваться таргетная терапия остеоартроза с воздействием на ключевые молекулы, принимающие участие в патогенезе этого заболевания и, прежде всего, на конкретные энзимы и цитокины, в частности ингибиторы синтеза металлопротеиназ (МПП 13, катепсин К) или более активных антагонистов ИЛ–1 (ИЛ–1Ra, антитела к анти–ИЛ–1 рецептору, ИЛ–1trap), ингибиторы ИЛ–1 конвертирующего энзима (ICE), ингибиторы INOS (индуцибельная оксид азота синтаза). Будут разработаны препараты, воздействующие на факторы роста (рекомбинантный человеческий IGF), а также нормализующие метаболизм субхондральной кости. С расширением знаний об интимных механизмах развития остеоартроза появятся и другие точки приложения медикаментозной терапии. Значительные успехи молекулярной биологии позволяют надеяться на разработку высокоэффективных препаратов, способных задержать прогрессирование остеоартроза и изменить его течение.
Будут разработаны препараты, воздействующие на факторы роста (рекомбинантный человеческий IGF), а также нормализующие метаболизм субхондральной кости. С расширением знаний об интимных механизмах развития остеоартроза появятся и другие точки приложения медикаментозной терапии. Значительные успехи молекулярной биологии позволяют надеяться на разработку высокоэффективных препаратов, способных задержать прогрессирование остеоартроза и изменить его течение.
Анаболические процессы в скелетных мышцах человека: восстановление идентичности гормона роста и тестостерона
Обзор
. 2010 окт; 38 (3): 97-104. doi: 10.3810/psm.2010.10.1814.Дэниел В. Д. Уэст 1 , Стюарт М. Филлипс
принадлежность
- 1 Исследовательская группа метаболизма при физических нагрузках, кафедра кинезиологии, Университет Макмастера, Гамильтон, Онтарио, Канада.

- PMID: 20959702
- DOI: 10.3810/псм.2010.10.1814
Обзор
Daniel WD West et al. ФизСпортмед. 2010 Октябрь
. 2010 окт; 38 (3): 97-104. doi: 10.3810/psm.2010.10.1814.Авторы
Дэниел В. Д. Вест 1 , Стюарт М Филлипс
принадлежность
- 1 Исследовательская группа метаболизма при физических нагрузках, кафедра кинезиологии, Университет Макмастера, Гамильтон, Онтарио, Канада.
- PMID: 20959702
- DOI:
10.
 3810/псм.2010.10.1814
3810/псм.2010.10.1814
Абстрактный
Добавки тестостерона действуют через многочисленные механизмы как сильнодействующий анаболический агент для скелетных мышц. Хотя гормон роста (ГР) сильно влияет на синтез коллагена и липолиз, а также на увеличение мышечной массы тела, он не оказывает анаболического действия на сократительную (то есть миофибриллярную) мышечную ткань у здоровых людей. Тем не менее, существует устойчивое мнение (как в научной литературе, так и среди тяжелоатлетов-любителей), что вызванное физическими упражнениями высвобождение ГР и тестостерона поддерживает мышечную гипертрофию при тренировках с отягощениями. Это преждевременное предположение, потому что, хотя фармакологические добавки ГР могут увеличить мышечную силу или размер у людей с клиническим дефицитом ГР, нет никаких доказательств того, что временные изменения ГР, вызванные физическими упражнениями, имеют такие же эффекты у людей с нормальными уровнями ГР. Парадигмы упражнений разработаны на основе предположения (не обязательно основанного на доказательствах механизмах), что ГР и тестостерон способствуют анаболическим процессам, которые приводят к увеличению и гипертрофии белков скелетных мышц. Наша недавняя работа оспаривает это предположение. Вместо этого наши данные показывают, что вызванное физическими упражнениями повышение уровня гормонов не усиливает внутриклеточные маркеры анаболической передачи сигналов или острого постнагрузочного повышения синтеза миофибриллярного белка. Кроме того, данные нашего тренировочного исследования показывают, что вызванное физическими упражнениями увеличение уровня ГР и доступности тестостерона не является необходимым и не способствует адаптации к силе и гипертрофии. Вместо этого наши данные позволяют сделать вывод, что локальные механизмы, свойственные ткани скелетных мышц, выполняющей резистивные сокращения (т. е. поднятие тяжестей), преобладают в стимуляции анаболизма. Цель этой статьи: 1) дать краткий обзор механизмов действия тестостерона и ГР; 2) обсудить неспособность повышения уровня этих гормонов, вызванного физиологическими упражнениями, оказывать измеримое влияние на анаболизм скелетных мышц; и 3) описать факторы, которые, по нашему мнению, более важны для стимуляции гипертрофии скелетных мышц человека.
Парадигмы упражнений разработаны на основе предположения (не обязательно основанного на доказательствах механизмах), что ГР и тестостерон способствуют анаболическим процессам, которые приводят к увеличению и гипертрофии белков скелетных мышц. Наша недавняя работа оспаривает это предположение. Вместо этого наши данные показывают, что вызванное физическими упражнениями повышение уровня гормонов не усиливает внутриклеточные маркеры анаболической передачи сигналов или острого постнагрузочного повышения синтеза миофибриллярного белка. Кроме того, данные нашего тренировочного исследования показывают, что вызванное физическими упражнениями увеличение уровня ГР и доступности тестостерона не является необходимым и не способствует адаптации к силе и гипертрофии. Вместо этого наши данные позволяют сделать вывод, что локальные механизмы, свойственные ткани скелетных мышц, выполняющей резистивные сокращения (т. е. поднятие тяжестей), преобладают в стимуляции анаболизма. Цель этой статьи: 1) дать краткий обзор механизмов действия тестостерона и ГР; 2) обсудить неспособность повышения уровня этих гормонов, вызванного физиологическими упражнениями, оказывать измеримое влияние на анаболизм скелетных мышц; и 3) описать факторы, которые, по нашему мнению, более важны для стимуляции гипертрофии скелетных мышц человека. Мы надеемся, что прояснение роли гормонов в регуляции мышечной массы, а также лежащей в основе адаптации скелетных мышц к упражнениям с отягощениями улучшит и поддержит назначение упражнений с отягощениями как неотъемлемого компонента здорового образа жизни.
Мы надеемся, что прояснение роли гормонов в регуляции мышечной массы, а также лежащей в основе адаптации скелетных мышц к упражнениям с отягощениями улучшит и поддержит назначение упражнений с отягощениями как неотъемлемого компонента здорового образа жизни.
Похожие статьи
- Гипертрофическая адаптация после тренировки: пересмотр гормональной гипотезы и ее применимости к разработке программы тренировок с отягощениями.
Шенфельд Б.Дж. Шенфельд Б.Дж. J Прочность Конд Рез. 2013 июнь;27(6):1720-30. doi: 10.1519/JSC.0b013e31828ddd53. J Прочность Конд Рез. 2013. PMID: 23442269 Обзор.
- Опосредованная физическими упражнениями гипертрофия скелетных мышц человека является внутренним процессом.
West DW, Burd NA, Staples AW, Phillips SM. Уэст Д.
 У. и др.
Int J Biochem Cell Biol. 2010 сен; 42 (9): 1371-5. doi: 10.1016/j.biocel.2010.05.012. Epub 2010 9 июня.
Int J Biochem Cell Biol. 2010.
PMID: 20541030
У. и др.
Int J Biochem Cell Biol. 2010 сен; 42 (9): 1371-5. doi: 10.1016/j.biocel.2010.05.012. Epub 2010 9 июня.
Int J Biochem Cell Biol. 2010.
PMID: 20541030 - Улучшение мышечной массы: реакция мышечного метаболизма на упражнения, питание и анаболические агенты.
Типтон К.Д., Феррандо А.А. Типтон К.Д. и др. Очерки биохим. 2008;44:85-98. DOI: 10.1042/BSE0440085. Очерки биохим. 2008. PMID: 18384284 Обзор.
- Гормон роста и состав тела у спортсменов.
Фриш Х. Фриш Х. Дж Эндокринол Инвест. 1999;22(5 Дополнение):106-9. Дж Эндокринол Инвест. 1999. PMID: 10442579Обзор.
- Увеличение анаболизма мышечного белка: роль качества белка.

Тан Дж. Э., Филлипс СМ. Танг Дж. Э. и соавт. Curr Opin Clin Nutr Metab Care. 2009 Январь; 12 (1): 66-71. doi: 10.1097/MCO.0b013e32831cef75. Curr Opin Clin Nutr Metab Care. 2009. PMID: 19057190 Обзор.
Посмотреть все похожие статьи
Цитируется
- Саркопения при ревматоидном артрите. Повествовательный обзор.
Мошоу Д., Крикелис М., Георгакопулос К., Моле Э., Хронопулос Э., Турнис С., Маврагани К., Макрис К., Донтас И., Гази С. Мошоу Д. и соавт. J Frailty Саркопения Фоллс. 2023 1 марта; 8 (1): 44–52. doi: 10.22540/JFSF-08-044. Электронная коллекция 2023 март. J Frailty Саркопения Фоллс. 2023. PMID: 36873824 Бесплатная статья ЧВК. Обзор.
- Распространенность низкой доступности энергии и связь с сезонными изменениями гормонов слюны и IgA у элитных гэльских футболистов-мужчин.

Макгуайр А., Уоррингтон Г., Дойл Л. Макгуайр А. и др. Евр Дж Нутр. 2023 июнь;62(4):1809-1820. doi: 10.1007/s00394-023-03112-0. Epub 2023 26 февраля. Евр Дж Нутр. 2023. PMID: 36841899 Бесплатная статья ЧВК.
- Материнский тестостерон влияет на активность теломеразы потомства у долгоживущих морских птиц.
Ногера Х.С., Веландо А. Ногера Дж. К. и соавт. Эколь Эвол. 2022 12 сентября; 12 (9): e9281. doi: 10.1002/ece3.9281. электронная коллекция 2022 сент. Эколь Эвол. 2022. PMID: 36110870 Бесплатная статья ЧВК.
- Саркопения: этиология, подходы к питанию и микроРНК.
Каннатаро Р., Карбоне Л., Петро Х.Л., Сионе Э., Варгас С., Ангуло Х., Фореро Д.А., Одриосола-Мартинес А., Крайдер Р.Б., Бонилья Д.А. Каннатаро Р.
 и соавт.
Int J Mol Sci. 2021 8 сентября; 22 (18): 9724. дои: 10.3390/ijms22189724.
Int J Mol Sci. 2021.
PMID: 34575884
Бесплатная статья ЧВК.
Обзор.
и соавт.
Int J Mol Sci. 2021 8 сентября; 22 (18): 9724. дои: 10.3390/ijms22189724.
Int J Mol Sci. 2021.
PMID: 34575884
Бесплатная статья ЧВК.
Обзор. - Влияние различных типов упражнений с отягощениями для нижней части тела на силу верхней части тела у мужчин и женщин с особым упором на анаболические гормоны.
Якобссон Дж., Теос А., Мальм С. Джейкобссон Дж. и соавт. Int J Exerc Sci. 2021 1 августа; 14 (3): 1052-1069. Электронная коллекция 2021. Int J Exerc Sci. 2021. PMID: 34567364 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- Канадские институты медицинских исследований/Канада
Анаболизм – анаболизм, клеточный, катаболизм и реакции
Анаболизм или биосинтез – это процесс, посредством которого живые организмы синтезируют сложные молекулы жизни из более простых. Анаболизм вместе с катаболизмом представляют собой две серии химических процессов в клетках, которые вместе называются метаболизм . Анаболические реакции представляют собой расходящиеся процессы. То есть для синтеза самых разнообразных конечных продуктов используется относительно небольшое количество видов сырья. Это приводит к увеличению размера или сложности клеток — или к тому и другому одновременно.
Анаболизм вместе с катаболизмом представляют собой две серии химических процессов в клетках, которые вместе называются метаболизм . Анаболические реакции представляют собой расходящиеся процессы. То есть для синтеза самых разнообразных конечных продуктов используется относительно небольшое количество видов сырья. Это приводит к увеличению размера или сложности клеток — или к тому и другому одновременно.
Анаболические процессы производят пептиды, белки , полисахариды, липиды и нуклеиновые кислоты. Эти молекулы включают в себя все материалы живых клеток, такие как мембраны и хромосомы, а также специализированные продукты определенных типов клеток, такие как ферменты, антитела, гормоны и нейротрансмиттеры.
Катаболизм, противоположный анаболизму, производит более мелкие молекулы, используемые клеткой для синтеза более крупных молекул, как будет описано ниже. Таким образом, в отличие от дивергентных реакций анаболизма, катаболизм представляет собой конвергентный процесс, в котором многие различные типы молекул расщепляются на относительно небольшое количество конечных продуктов.
Энергия , необходимая для анаболизма, обеспечивается богатыми энергией молекула аденозинтрифосфата (АТФ). Эта энергия существует в виде высокоэнергетической химической связи между второй и третьей молекулой фосфата на АТФ. Энергия АТФ высвобождается, когда эта связь разрывается, превращая АТФ в аденозиндифосфат (АДФ). Во время анаболических реакций высокоэнергетическая фосфатная связь АТФ переносится на субстрат (молекулу, обработанную ферментом ), чтобы зарядить ее энергией для подготовки к последующему использованию молекулы в качестве сырья для синтеза более крупного вещества. молекула. В дополнение к АТФ некоторые анаболические процессы также требуют высокой энергии 9.0163 атома водорода , поставляемые молекулой НАДФН.
Хотя анаболизм и катаболизм происходят в клетке одновременно, скорости их химических реакций контролируются независимо друг от друга. Например, существует два ферментативных пути метаболизма глюкозы. Анаболический путь синтезирует глюкозу, а катаболизм расщепляет глюкозу. Эти два пути разделяют 9 из 11 ферментативных стадий метаболизма глюкозы, которые могут происходить в любой последовательности (т. е. в направлении анаболизма или катаболизма). Однако две стадии анаболизма глюкозы используют совершенно другой набор катализируемых ферментами реакций.
Анаболический путь синтезирует глюкозу, а катаболизм расщепляет глюкозу. Эти два пути разделяют 9 из 11 ферментативных стадий метаболизма глюкозы, которые могут происходить в любой последовательности (т. е. в направлении анаболизма или катаболизма). Однако две стадии анаболизма глюкозы используют совершенно другой набор катализируемых ферментами реакций.
Есть две важные причины, по которым клетка должна иметь отдельные взаимодополняющие анаболические и катаболические пути. Во-первых, катаболизм — это так называемый «нисходящий» процесс, во время которого высвобождается энергия, в то время как анаболизм требует ввода энергии и, следовательно, является энергетически «восходящим» процессом. В определенные моменты анаболического пути клетка должна вкладывать в реакцию больше энергии, чем высвобождается при катаболизме. Такие анаболические стадии требуют другой последовательности реакций, чем те, которые используются на этом этапе катаболизма.
Во-вторых, различные пути позволяют клетке контролировать анаболические и катаболические пути определенных молекул независимо друг от друга. Это важно, потому что бывают случаи, когда клетка должна замедлить или остановить определенный катаболический или анаболический путь, чтобы уменьшить распад или синтез определенной молекулы. Если бы и анаболизм, и катаболизм использовали один и тот же путь, клетка не смогла бы контролировать скорость каждого процесса независимо от другого: замедление скорости катаболизма замедлит скорость анаболизма.
Это важно, потому что бывают случаи, когда клетка должна замедлить или остановить определенный катаболический или анаболический путь, чтобы уменьшить распад или синтез определенной молекулы. Если бы и анаболизм, и катаболизм использовали один и тот же путь, клетка не смогла бы контролировать скорость каждого процесса независимо от другого: замедление скорости катаболизма замедлит скорость анаболизма.
В разных частях одной и той же клетки могут происходить противоположные анаболические и катаболические пути. Например, в печени расщепление жирных кислот до молекулы ацетил-КоА происходит внутри митохондрий. Митохондрии — это крошечные, связанные с мембраной органеллы, которые функционируют как основное место производства АТФ в клетке. Накопление жирных кислот из ацетил-КоА происходит в цитозоле клетки, то есть в водной области клетки, содержащей различные растворенные вещества.
Хотя анаболический и катаболический пути контролируются независимо, оба метаболических пути имеют важную общую последовательность реакций, известную под общим названием лимонная кислота цикл, или цикл Кребса . Цикл Кребса является частью более крупной серии ферментативных реакций, которые в совокупности называются окислительным фосфорилированием. Этот путь является важным средством расщепления глюкозы для производства энергии, которая запасается в форме АТФ. Но молекулы, произведенные циклом Кребса, также могут использоваться в качестве молекул-предшественников или сырья для анаболических реакций, в результате которых образуются белки, жиры и углеводы.
Цикл Кребса является частью более крупной серии ферментативных реакций, которые в совокупности называются окислительным фосфорилированием. Этот путь является важным средством расщепления глюкозы для производства энергии, которая запасается в форме АТФ. Но молекулы, произведенные циклом Кребса, также могут использоваться в качестве молекул-предшественников или сырья для анаболических реакций, в результате которых образуются белки, жиры и углеводы.
Несмотря на независимость анаболизма и катаболизма, различные этапы этих процессов в некотором роде настолько тесно связаны, что образуют то, что можно было бы назвать «энзиматической экологической системой». В этой системе изменение одной части метаболической последовательности реакций может иметь волновой эффект во всех связанных анаболических и катаболических путях.
Этот волновой эффект представляет собой клеточный способ уравновешивания увеличения или уменьшения анаболизма молекулы противоположным увеличением или уменьшением катаболизма. Это позволяет клетке регулировать скорость анаболических и катаболических реакций в соответствии со своими непосредственными потребностями и предотвращать дисбаланс анаболических или катаболических продуктов.
Это позволяет клетке регулировать скорость анаболических и катаболических реакций в соответствии со своими непосредственными потребностями и предотвращать дисбаланс анаболических или катаболических продуктов.
Например, когда клетке необходимо производить определенные белки, она производит ровно столько каждой из аминокислот, сколько необходимо для синтеза этих белков. Кроме того, некоторые аминокислоты используются клеткой для производства глюкозы, которая появляется в кровь или гликоген, углевод хранящийся в печени. Таким образом, продукты катаболизма аминокислот не накапливаются, а питают анаболические пути синтеза углеводов. Таким образом, в то время как многие организмы хранят богатые энергией питательные вещества , такие как углеводы и жир , большинство из них не хранит другие биомолекулы, такие как белки или нуклеиновые кислоты, строительные блоки дезоксирибонуклеиновой кислоты (ДНК) .
Клетка регулирует скорость анаболических реакций с помощью аллостерических ферментов.

